Giải bài tập SBT Hóa 10 Bài 30: Lưu huỳnh
Dựa theo nội dung SBT Hóa học 10 eLib xin giới thiệu đến các em học sinh bài giải bài Lưu huỳnh. Bài này sẽ giúp các em nắm vững được lý thuyết cũng như cách giải các bài tập đầy đủ, chi tiết và rõ ràng. Hy vọng đây sẽ là tài liệu tham khảo hữu ích với các em học sinh.
Mục lục nội dung
1. Giải bài 30.1 trang 66 SBT Hóa học 10
2. Giải bài 30.2 trang 66 SBT Hóa học 10
3. Giải bài 30.3 trang 66 SBT Hóa học 10
4. Giải bài 30.4 trang 66 SBT Hóa học 10
5. Giải bài 30.5 trang 67 SBT Hóa học 10
6. Giải bài 30.6 trang 67 SBT Hóa học 10
7. Giải bài 30.7 trang 67 SBT Hóa học 10
8. Giải bài 30.8 trang 67 SBT Hóa học 10
9. Giải bài 30.9 trang 67 SBT Hóa học 10

1. Giải bài 30.1 trang 66 SBT Hóa học 10
Câu nào sau đây diễn tả đúng tính chất hoá học của lưu huỳnh ?
A. Lưu huỳnh chỉ có tính oxi hoá.
B. Lưu huỳnh chỉ có tính khử.
C. Lưu huỳnh vừa có tính oxi hoá, vừa có tính khử.
D. Lưu huỳnh không cố tính oxi hoá và không có tính khử.
Phương pháp giải
Xem lại lý thuyết về lưu huỳnh.
Hướng dẫn giải
Lưu huỳnh vừa có tính oxi hoá, vừa có tính khử.
Đáp án C
2. Giải bài 30.2 trang 66 SBT Hóa học 10
Liên kết hoá học giữa nguyên tử của nguyên tố nào với nguyên tử natri trong hợp chất sau thuộc loại liên kết cộng hoá trị có cực ?
A. Na2S
B. Na2O
C. NaCl
D. NaF
Phương pháp giải
Xem lại lý thuyết về lưu huỳnh.
Căn cứ vào hiệu độ âm điện của các nguyên tố để xác định loại liên kết hóa học.
Hướng dẫn giải
Trong F, O, Cl, S thì S có độ âm điện nhỏ nhất → Na2S có liên kết cộng hóa trị phân cực
Đáp án A
3. Giải bài 30.3 trang 66 SBT Hóa học 10
Cho PTHH: 4FeS2 + 11O2 → 2Fe2O3 + 8SO2
Cần đốt cháy bao nhiêu mol FeS2 để thu được 64 gam SO2 theo PTHH trên ?
A. 0,4 mol.
B. 0,5 mol.
C. 0,8 mol.
D. 1,2 mol.
Phương pháp giải
Tính theo PTHH:
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
1 mol → 2 mol
x mol
Tính x
Hướng dẫn giải
PTHH:
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
1 mol → 2 mol
x mol 64 : 64 = 1 mol
→ x = 0,5 mol
→ Chọn B
4. Giải bài 30.4 trang 66 SBT Hóa học 10
Câu nào sau đây đúng
A. Lưu huỳnh ở ô 32 trong bảng HTTH
B. Lưu huỳnh ở thể khí trong điều kiện thường
C. Lưu huỳnh vừa có tính oxi hóa, vừa có tính khử
D. Lưu huỳnh luôn có số oxi hóa -2 trong mọi hợp chất
Phương pháp giải
Xem lại lý thuyết về lưu huỳnh.
Hướng dẫn giải
A. Sai vì lưu huỳnh có Z = 16, ở ô số 16 trong bảng HTTH.
B. Sai vì lưu huỳnh ở thế rắn.
C. Đúng
D. Sai vì lưu huỳnh có số oxi hóa -2, +4, +6.
→ Chọn C.
5. Giải bài 30.5 trang 67 SBT Hóa học 10
Lưu huỳnh có các số oxi hóa nào sau đây
A. -2; -4; +6; +8
B. -1; 0; +2; +4
C. -2; +6; +4: 0
D. -2; -4; -6; 0
Phương pháp giải
Xem lại lý thuyết về lưu huỳnh
Hướng dẫn giải
Lưu huỳnh có các số oxi hóa là: -2; +6; +4; 0
→ Chọn C
6. Giải bài 30.6 trang 67 SBT Hóa học 10
Đốt nóng một hỗn hợp gồm 5,6 gam bột sắt và 1,6 gam bột lưu huỳnh trong môi trường không có không khí, thu được hỗn hợp rắn X. Cho hỗn hợp X phản ứng hoàn toàn với 500 ml dung dịch HCl, thu được hỗn hợp khí A và dung dịch B (hiệu suất của các phản ứng là 100%).
a) Tính thành phần phần trăm theo thể tích của hỗn hợp khí A.
b) Biết rằng cần dùng 125 ml dung dịch NaOH 0,1M để trung hoà HCl còn dư trong dung dịch B, hãy tính nồng độ mol của dung dịch HCl đã dùng.
Phương pháp giải
a) PTHH: Fe+ S → FeS (1)
FeS + 2HCl → FeCl2 + H2S (2)
Fe(dư) + 2HCl → FeCl2 + H2 (3)
Tính số mol theo PTHH
b) Tổng số mol HCl tham gia các phản ứng (2), (3), (4) :
0,1 + 0,1 + 0,0125 = 0,2125 (mol)
Nồng độ mol của dung dịch HCl: \(\dfrac{{0,2125}}{{0,5}} = 0,425 mol/l\)
Hướng dẫn giải
Các PTHH:
Fe + S → FeS (1)
FeS + 2HCl → FeCl2 + H2S (2)
Fe(dư) + 2HCl → FeCl2 + H2 (3)
HCl (dư) + NaOH → NaCl + H2O (4)
a) Thành phần của hỗn hợp khí A :
Theo (1): 0,05 mol Fe tác dụng với 0,05 mol S, sinh ra 0,05 mol FeS.
Theo (2): 0,05 mol FeS tác dụng với 0,10 mol HCl, sinh ra 0,05 mol H2S
Theo (3): 0,05 moi Fe dư tác dụng với 0,10 mol HCl, sinh ra 0,05 mol HCl
Kết luận: Hỗn hợp khí A có thành phần phần trăm theo thể tích :
50% khí H2S và 50% khí H2
b) Nồng độ mol của dung dịch HCl :
Tổng số mol HCL tham gia các phản ứng (2), (3), (4) :
0,1 + 0,1 + 0,0125 = 0,2125 (mol)
Nồng độ mol của dung dịch HCl: 0,2125/0,5 = 0,425 (mol/l)
7. Giải bài 30.7 trang 67 SBT Hóa học 10
Viết phương trình hoá học của các phản ứng hoàn thành chuỗi phản ứng sau:
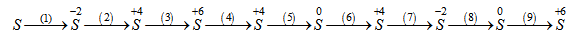
Phương pháp giải
Xem lại lý thuyết về lưu huỳnh
Hướng dẫn giải
(1) S + H2 to → H2S
(2) 2H2S + 3O2 to → 2SO2 + 2H2O
(3) SO2 + Br2 + 2H2O to → H2SO4 + 2HBr
(4) Cu + H2SO4 đặc nóng → CuSO4 + SO2 + 2H2O
(5) SO2 + 2Mg → S + 2MgO
(6) S + O2 to → SO2
(7) SO2 + 6HI → H2S + 3I2 + 2H2O
(8) H2S + Cl2 → S + 2HCl
(9) S + 6HNO3 đặc nóng → H2SO4 + 6NO2 + 2H2O
8. Giải bài 30.8 trang 67 SBT Hóa học 10
Cho sơ đồ chuỗi phản ứng:
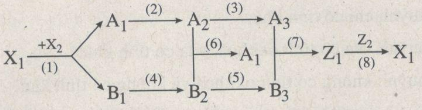
Biết rằng : X1 là hợp chất của 1 kim loại và 1 phi kim.
A1, A2, A3, Z1 là các hợp chất của lưu huỳnh
B1, B3, B5, Z1 là hợp chất của đồng hoặc đồng kim loại.
Hãy viết PTHH của chuỗi phản ứng (có ghi điều kiện) xảy ra theo sơ đồ trên.
Phương pháp giải
Xem lại lý thuyết về lưu huỳnh
Hướng dẫn giải
CuS + 3/2O2 to→ CuO + SO2 (1)
SO2 + Br2 + 2H2O → 2HBr + H2SO4 (2)
H2SO4 + Ag2O → Ag2SO4 + H2O (3)
CuO + H2 to→ Cu + H2O (4)
Cu + Cl2 to→ CuCl2 (5)
Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O (6)
Ag2SO4 + CuCl2 → 2AgCl + CuSO4 (7)
CuSO4 + H2S → CuS + H2SO4 (8)
9. Giải bài 30.9 trang 67 SBT Hóa học 10
Cho 1,10 gam hỗn hợp bột sắt và bột nhôm tác dụng vừa đủ với 1,28 gam bột lưu huỳnh.
a) Viết PTHH của các phản ứng đã xảy ra.
b) Tính tỉ lệ % của sắt và nhôm trong hỗn hợp ban đầu theo :
+ Lượng chất (số mol).
+ Khối lượng chất (số gam).
Phương pháp giải
Fe + S → FeS (1)
x x (mol)
2Al + 3S to→ Al2S3
y 3y/2(mol)
Đặt số mol Fe, Al lần lượt là x,y ta có hệ phương trình:
56x + 27y = 1,1
(x +3y/2).32 = 1,28
Giải ra x = 0,01 và y = 0,02
Tính % số mol và % khối lượng theo số mol đã tính.
Hướng dẫn giải
Fe + S → FeS (1)
x x (mol)
2Al + 3S to→ Al2S3
y 3y/2(mol)
Đặt số mol Fe, Al lần lượt là x,y ta có hệ phương trình:
56x + 27y = 1,1
(x +3y/2).32 = 1,28
Giải ra x = 0,01 và y = 0,02
b) %nFe = 0,01/0,03 x 100% = 33,33%; %nAl = 100 - 33,33% = 66,667%
%mFe = 56.0,01/1,1 x 100% = 50,90%; %mAl = 100 - 50,90 = 49,1 (%)
10. Giải bài 30.10 trang 68 SBT Hóa học 10
Đun nóng một hỗn hợp gồm có 0,650 gam bột kẽm và 0,224 gam bột lưu huỳnh trong ống nghiệm đậy kín không có không khí. Sau phản ứng người ta thu được chất nào trong ống nghiệm ? Khối lượng là bao nhiêu ?
Phương pháp giải
nZn = 0,65 : 65 = 0,01 mol; nS = 0,224 : 32 = 0,007 mol
Zn + S → ZnS (1)
→ Zn dư, Tính số mol ZnS theo số mol S.
Hướng dẫn giải
nZn = 0,65 : 65 = 0,01 mol; nS = 0,224 : 32 = 0,007 mol
Zn + S → ZnS (1)
Theo (1) sau phản ứng trong ống nghiệm thu được:
nZnS = 0,007 mol
mZnS = 0,007.97 = 0,679 (g)
nZn dư = (0,01 - 0,007) = 0,003 mol
mZn dư = 65.0,003 = 0,195g
11. Giải bài 30.11 trang 68 SBT Hóa học 10
Đốt cháy lưu huỳnh trong bình đựng không khí, lưu huỳnh cháy hết. Tính tỉ khối đối với He của hỗn hợp khí thu được sau phản ứng, nếu oxi trong bình vừa đủ đốt cháy hết S.
Phương pháp giải
Nitơ chiếm 80% thể tích không khí, điều đó có nghĩa là trong không khí mỗi khi có 1 mol oxi sẽ có 4 mol nitơ.
\( S + O_2 → SO_2\)
Khi tạo thành 1 mol \(SO_2\) thì hỗn hợp thu được gồm 1 mol \(SO_2\) và 4 mol \(N_2\)
Tính khối lượng mol trung bình của hỗn hợp: \(\overline M = \dfrac{{{M_1}.{x_1} + {M_2}.{x_2} + ... + {M_n}.{x_n}}}{{{x_1} + {x_2} + ... + {x_n}}} \)
trong đó x1, x2,..xn là số mol
Tính tỉ khối \({d_{hh/He}} = \dfrac{{\overline {{M_{hh}}} }}{4}\)
Hướng dẫn giải
Nitơ chiếm 80% thể tích không khí, điều đó có nghĩa là trong không khí mỗi khi có 1 mol oxi sẽ có 4 mol nitơ.
S + O2 → SO2
Khi tạo thành 1 mol SO2 thì hỗn hợp thu được gồm 1 mol SO2 và 4 mol N2
\(\overline M = \frac{{64 + 28.4}}{5} = 35,2(g/mol)\)
Tỉ khối của hỗn hợp đối với He là: d = 35,2 : 4 = 8,8
Tham khảo thêm
- doc Giải bài tập SBT Hóa 10 Bài 29: Oxi - Ozon
- doc Giải bài tập SBT Hóa 10 Bài 32: Hiđro sunfua - Lưu huỳnh đioxit - Lưu huỳnh trioxit
- doc Giải bài tập SBT Hóa 10 Bài 33: Axit sunfuric - Muối sunfat
- doc Giải bài tập SBT Hóa 10 Bài 34: Luyện tập: Oxi và lưu huỳnh



