Giải bài tập SBT Hóa 10 Bài 11: Luyện tập: Bảng tuần hoàn, sự biến đổi tuần hoàn cấu hình electron nguyên tử và tính chất của các NTHH
Dựa theo nội dung SBT Hóa học 10 eLib xin giới thiệu đến các em học sinh bài giải Luyện tập Bảng tuần hoàn, Bài này sẽ giúp các em nắm vững được lý thuyết cũng như cách giải các bài tập của bài Luyện tập đầy đủ, chi tiết và rõ ràng. Hy vọng đây sẽ là tài liệu tham khảo hữu ích với các em học sinh.
Mục lục nội dung
1. Giải bài 11.1 trang 26 SBT Hóa học 10
2. Giải bài 11.2 trang 26 SBT Hóa học 10
3. Giải bài 11.3 trang 26 SBT Hóa học 10
4. Giải bài 11.4 trang 27 SBT Hóa học 10
5. Giải bài 11.5 trang 27 SBT Hóa học 10
6. Giải bài 11.6 trang 27 SBT Hóa học 10
7. Giải bài 11.7 trang 27 SBT Hóa học 10
8. Giải bài 11.8 trang 27 SBT Hóa học 10
9. Giải bài 11.9 trang 28 SBT Hóa học 10
10. Giải bài 11.10 trang 28 SBT Hóa học 10
11. Giải bài 11.11 trang 28 SBT Hóa học 10
12. Giải bài 11.12 trang 28 SBT Hóa học 10
13. Giải bài 11.13 trang 28 SBT Hóa học 10
14. Giải bài 11.14 trang 28 SBT Hóa học 10
15. Giải bài 11.15 trang 28 SBT Hóa học 10
1. Giải bài 11.1 trang 26 SBT Hóa học 10
Trong các nguyên tố sau, nguyên tử của nguyên tố có bán kính lớn nhất là
A. O
B. F
C. N
D. Al.
Phương pháp giải
Xem lại lý thuyết sự biến đổi tuần hoàn tính chất hóa học của nguyên tố hóa học.
Hướng dẫn giải
N, O, F thuộc cùng chu kì 2 → thứ tự bán kính tăng dần: F, O, N
Al thuộc chu kì 3 → Al có bán kính lớn nhất
→ Chọn D
2. Giải bài 11.2 trang 26 SBT Hóa học 10
Cho các nguyên tố : Ca, C, F, O, Be.
a) Dãy nguyên tố sắp xếp theo chiều tăng dần độ âm điện của nguyên tử là
A. C, F, Ca, O, Be.
B. Ca, Be, C, O, F
C. F, O, C, Be, Ca
D. O, C, F, Ca, Be.
b) Dãy nguyên tố sắp xếp theo chiều tăng dần của bán kính nguyên tử là
A. C, F, O, Be, Ca.
B. Ca, Be, C, O, F
C. F, C, O, Ca, Be.
D. F, O, C, Be, Ca.
Phương pháp giải
Xem lại lý thuyết sự biến đổi tuần hoàn tính chất hóa học của nguyên tố hóa học.
Hướng dẫn giải
a) Be, C, O, F thuộc cùng chu kì 2 → thứ tự tăng dần độ âm điện: Be, C, O, F
Ca thuộc chu kì 4 → thứ tự tăng dần độ âm điện: Ca, Be, C, O, F
→ Chọn B
b) Be, C, O, F thuộc cùng chu kì 2 → thứ tự tăng dần bán kính nguyên tử: F, O, C, Be
Ca thuộc chu kì 4 → thứ tự tăng dần bán kính nguyên tử: F, O, C, Be, Ca
→ Chọn D
3. Giải bài 11.3 trang 26 SBT Hóa học 10
Khối lượng của nguyên tử beri \(\left( {{}_4^{9,012}Be} \right)\) bằng 9,012u.
a) Nguyên tử khối của beri bằng
A. 9.
B. 9,012.
C. 9,012 g/mol.
D 4.
b) Số khối hạt nhân nguyên tử beri bằng
A. 9.
B. 9,012.
C. 9,012 g/mol.
D 4.
c) Khối lượng mol nguyên tử beri bằng
A. 9.
B. 9,012.
C. 9,012 g/mol;
D 4.
Phương pháp giải
Xem lại lý thuyết sự biến đổi tuần hoàn tính chất hóa học của nguyên tố hóa học.
Hướng dẫn giải
a) Nguyên tử khối của Be là 9,012 đvC
→ Chọn B
b) Số khối hạt nhân nguyên tử Be là 9,012
→ Chọn B
c) Khối lượng mol nguyên tử Be là 9,012 g/mol
→ Chọn C
4. Giải bài 11.4 trang 27 SBT Hóa học 10
Khi cho hạt nhân \({}_2^{4}He\) bắn phá vào hạt nhân \({}_6^{12}C\), người ta thu được một nơtron và một hạt nhân Y. Y là hạt nhân nào cho dưới đây ?
A. \({}_8^{15}O\)
B. \({}_6^{13}C\)
C. \({}_7^{14}N\)
D. \({}_4^{9}Be\)
Phương pháp giải
Xét phương trình phản ứng hạt nhân:
\({}_2^4He + _6^{12}C\xrightarrow{{}}Y + _{}^1n\)
Áp dụng bào toàn proton và bảo toàn số khối
Hướng dẫn giải
Xét phương trình phản ứng hạt nhân:
\({}_2^4He + _6^{12}C\xrightarrow{{}}Y + _{}^1n\)
Áp dụng bào toàn proton và bảo toàn số khối
→ Y có số khối A = 12 + 4 - 1 = 15,
→ số p Z = 2 + 6 - 0 = 8
→ Y là \({}_8^{15}O\)
→ Chọn A
5. Giải bài 11.5 trang 27 SBT Hóa học 10
Các nguyên tố thuộc cùng một nhóm A thì
A. ở vỏ electron của nguyên tử các nguyên tố nhóm A đó có số electron như nhau.
B. có số lớp electron như nhau,
C. có số e ngoài cùng như nhau
D. có cùng số electron s hay p.
Phương pháp giải
Xem lại lý thuyết bảng tuần hoàn các nguyên tố hóa học
Hướng dẫn giải
Các nguyên tố thuộc cùng một nhóm A thì có số e ngoài cùng như nhau
→ Chọn C
6. Giải bài 11.6 trang 27 SBT Hóa học 10
Nguyên tử của nguyên tố X là \([Ar]3d^54s^2\). Vị trí của X trong bảng tuần hoàn là
A. chu kì 4, nhóm IIA.
B. chu kì 4, nhóm IIB.
C. chu kì 4, nhóm VIIA
D. chu kì 4, nhóm VIIB.
Phương pháp giải
Xem lại lí thuyết về ý nghĩa bảng tuần hoàn các nguyên tố hóa học
Hướng dẫn giải
X có 4 lớp e nên thuộc chu kì 4
X có 7e hóa trị và là nguyên tố d nên thuộc nhóm VIIB
→ Chọn D
7. Giải bài 11.7 trang 27 SBT Hóa học 10
Cho cấu hình electron của Zn là \([Ar]3d^{10}4s^2\). Vị trí của Zn trong bảng tuần hoàn là
A. ô 29, chu kì 4, nhóm IIA.
B. ô 30, chu kì 4, nhóm IIA.
C. ô 30, chu kì 4, nhóm IIB.
D. ô 30, chu kì 4, nhóm IIIB.
Phương pháp giải
Xem lại lí thuyết về ý nghĩa bản tuần hoàn các nguyên tố hóa học
Hướng dẫn giải
Cấu hình e đầy đủ của Zn: 1s22s22p63s23p63d104s2 (Z=30)
Zn có 4 lớp e nên thuộc chu kì 4
Zn có 2e hóa trị và là nguyên tố d nên thuộc nhóm IIB
→ Chọn C
8. Giải bài 11.8 trang 27 SBT Hóa học 10
Các nguyên tố từ Li đến F, theo chiều tăng của điện tích hạt nhân thì
A. bán kính nguyên tử tăng, độ âm điện giảm.
B. bán kính nguyên tử và độ âm điện đều tăng,
C. bán kính nguyên tử giảm, độ âm điện tăng.
D. bán kính nguyên tử và độ âm điện đều giảm.
Phương pháp giải
Xem lại lí thuyết về ý nghĩa bản tuần hoàn các nguyên tố hóa học
Hướng dẫn giải
Trong một chu kì theo chiều tăng ĐTHN, bán kính nguyên tử giảm, độ âm điện tăng
→ Chọn C
9. Giải bài 11.9 trang 28 SBT Hóa học 10
Hãy viết cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố thuộc chu kì 3.
Na (Z = 11), Mg (Z = 12), Al (Z = 13), Si (Z = 14), P (Z = 15), S (Z = 16), C1 (Z = 17).
Phương pháp giải
Xem lại lý thuyết về bảng tuần hoàn các nguyên tố hóa học
Hướng dẫn giải
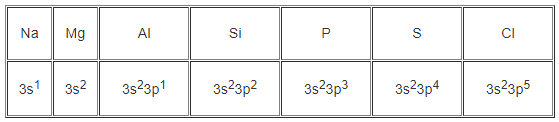
10. Giải bài 11.10 trang 28 SBT Hóa học 10
Hãy viết cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố thuộc nhóm IIA.
Be (Z = 4), Mg (Z = 12), Ca (Z = 20), Sr (Z = 38), Ba (Z = 56), Ra (Z = 88).
Phương pháp giải
Xem lại lý thuyết bảng tuần hoàn các nguyên tố hóa học
Hướng dẫn giải
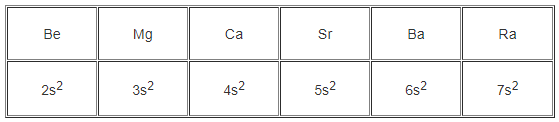
11. Giải bài 11.11 trang 28 SBT Hóa học 10
Các nguyên tố thuộc các nhóm B (từ IB đến VIIIB) có mặt trong các chu kì nhỏ không?
Phương pháp giải
Xem lại lí thuyết về bảng tuần hoàn các nguyên tố hóa học
Hướng dẫn giải
Các nguyên tố nhóm B đều là các nguyên tố d, f nên từ chu kì 4 trở đi mới xuất hiện các nguyên tố này
→ Các nguyên tố thuộc các nhóm B (từ IB đến VIIIB) không có mặt trong các chu kì nhỏ.
12. Giải bài 11.12 trang 28 SBT Hóa học 10
Trong tự nhiên, nguyên tố bo có 2 đồng vị: \({}^{11}B\), nguyên tử khối coi là bằng 11, thành phần 80,1% ; \({}^{10}B\), nguyên tử khối coi là bằng 10, thành phần 19,9%. Hãy tính nguyên tử khối trung bình của nguyên tố bo trong tự nhiên.
Phương pháp giải
Ta có: \(\overline A = \dfrac{{{M_1}.{x_1} + {M_2}.{x_2} + ... + {M_n}.{x_n}}}{{{x_1} + {x_2} + ... + {x_n}}} = \dfrac{{{M_1}.{x_1} + {M_2}.{x_2} + ... + {M_n}.{x_n}}}{{100}}\)
Hướng dẫn giải
Ta có: \(\overline A = \dfrac{{11.80,1 + 10.19,9 }}{{100}} = 10,8(đvC)\)
Nguyên tử khối trung bình của bo là 10,8 đvC
13. Giải bài 11.13 trang 28 SBT Hóa học 10
Một nguyên tố X ở nhóm VIA, chu kì 3.
a) Hãy viết cấu hình electron nguyên tử của nguyên tố X
b) Hãy cho biết số thứ tự của nguyên tố X trong bảng tuần hoàn các nguyên tố hoá học.
Phương pháp giải
a) X thuộc nhóm VIA → có 6e lớp ngoài cùng và là nguyên tố p
X thuộc chu kì 3 → X có 3 lớp e
b) Số thứ tự = số p = số e
Hướng dẫn giải
a) Nguyên tử X có 3 lớp electron, lớp ngoài cùng có 6 electron, vậy có cấu hình electron : 1s22s22p63s23p4
b) Số thứ tự bằng số proton và bằng số electron: Z = 16.
14. Giải bài 11.14 trang 28 SBT Hóa học 10
Nguyên tố X (thuộc nhóm A), có cấu hình electron lớp ngoài cùng của nguyên tử là 3s23p6
a) Hãy viết cấu hình electron nguyên tử (đầy đủ) của X.
b) Hãy cho biết số thứ tự của nguyên tố X trong bảng tuần hoàn các nguyên tố hoá học.
Phương pháp giải
a) X có cấu hình e lớp ngoài cùng 3s23p6 nên cấu hình lớp bên trong đã điền đầy e
b) số thứ tự = số p = số e
Hướng dẫn giải
a) X : 1s22s22p63s23p6
b) Số thứ tự bằng số proton và bằng số electron Z = 2 + 2 + 6 + 2 + 6= 18.
15. Giải bài 11.15 trang 28 SBT Hóa học 10
a) So sánh tính phi kim của Si (Z =14) với Al (Z = 13) và P (Z = 15).
b) So sánh tính phi kim của Si (Z = 14) với C (Z = 6) và Ge (Z = 32).
Phương pháp giải
Xem lại lý thuyết sự biến đổi tuần hoàn tính chất hóa học của nguyên tố hóa học.
Hướng dẫn giải
a) Al, Si, P thuộc cùng chu kì 3, theo sự tăng dần ĐTHN thì Si có tính phi kim mạnh hơn Al, yếu hơn P.
b) C, Si, Ge thuộc cùng nhóm IVA, theo sự tăng dần ĐTHN thì Si có tính phi kim mạnh hơn Ge, yếu hơn C.
16. Giải bài 11.16 trang 28 SBT Hóa học 10
Cho 5,05 gam hỗn hợp hai kim loại nhóm IA và thuộc hai chu kì liên tiếp vào nước (dư), thu được 1,68 lít khí hiđro (đktc) và dung dịch B. Tìm tên hai kim loại và khối lượng chất tan có trong dung dịch B.
Phương pháp giải
Gọi 2 kim loại là \(\overline M \)
\(\begin{array}{l}
\overline M + {H_2}O \to \overline M OH + 0,5{H_2}\\
0,15 \leftarrow \,\,\,\,\,\,\,\,\,\,\,\,\,\,0,15\,\,\,\, \leftarrow 0,075\,mol
\end{array}\)
→\(\overline M\)=33,67 → 2 kim loại
Hướng dẫn giải
Gọi 2 kim loại là \(\overline M \)
\(\begin{array}{l}
\overline M + {H_2}O \to \overline M OH + 0,5{H_2}\\
0,15 \leftarrow \,\,\,\,\,\,\,\,\,\,\,\,\,\,0,15\,\,\,\, \leftarrow 0,075\,mol
\end{array}\)
→\(\overline M\)=33,67 → Na (M=23) và K (M=39)
\({m_{\overline M OH}} = \left( {33,67 + 17} \right) \times 0.15 = 7,6\,gam\)
17. Giải bài 11.17 trang 28 SBT Hóa học 10
Cho 39,6 gam hỗn hợp hai muối cacbonat của hai kim loại đứng kế tiếp nhau trong nhóm IIA tác dụng hết với dung dịch HCl, thu được 6,72 lít khí \(CO_2\) (đktc). Xác định hai kim loại.
Phương pháp giải
Gọi 2 kim loại là \(\overline M \)
\(\begin{array}{l}
\overline M C{O_3} + 2HCl \to \overline M C{l_2} + {H_2}O + C{O_2}\\
0,3 \leftarrow\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,0,3\\
\to \overline M + 60 = \dfrac{{39,6}}{{0,3}} \to \overline M = 72 \end{array}\)
→ 2 kim loại
Hướng dẫn giải
Gọi 2 kim loại là \(\overline M \)
\(\begin{array}{l}
\overline M C{O_3} + 2HCl \to \overline M C{l_2} + {H_2}O + C{O_2}\\
0,3 \leftarrow \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,0,3\\
\to \overline M + 60 = \dfrac{{39,6}}{{0,3}} \to \overline M = 72 \to Ca\,(40)\,;\,Sr\,(88)
\end{array}\)
Tham khảo thêm
- doc Giải bài tập SBT Hóa 10 Bài 7: Bảng tuần hoàn các nguyên tố hóa học
- doc Giải bài tập SBT Hóa 10 Bài 8: Sự biến đổi tuần hoàn cấu hình electron nguyên tử
- doc Giải bài tập SBT Hóa 10 Bài 9: Sự biến đổi tính chất của các NTHH
- doc Giải bài tập SBT Hóa 10 Bài 10: Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học



