Giải bài tập SBT Hóa 10 Bài 39: Luyện tập: Tốc độ phản ứng và cân bằng hóa học
Dưới đây là nội dung chi tiết Giải bài tập SBT Hóa 10 Chương 7 Luyện tập, với hướng dẫn giải chi tiết, rõ ràng, trình bày khoa học. eLib hy vọng đây sẽ là tài liệu hữu ích giúp các bạn học sinh lớp 10 học tập thật tốt!
Mục lục nội dung
1. Giải bài 39.1 trang 85 SBT Hóa học 10
2. Giải bài 39.2 trang 86 SBT Hóa học 10
3. Giải bài 39.3 trang 86 SBT Hóa học 10
4. Giải bài 39.4 trang 86 SBT Hóa học 10
5. Giải bài 39.5 trang 86 SBT Hóa học 10
6. Giải bài 39.6 trang 86 SBT Hóa học 10
7. Giải bài 39.7 trang 87 SBT Hóa học 10
8. Giải bài 39.8 trang 87 SBT Hóa học 10
9. Giải bài 39.9 trang 87 SBT Hóa học 10
10. Giải bài 39.10 trang 87 SBT Hóa học 10
11. Giải bài 39.11 trang 88 SBT Hóa học 10
12. Giải bài 39.12 trang 88 SBT Hóa học 10
13. Giải bài 39.13 trang 88 SBT Hóa học 10
14. Giải bài 39.14 trang 88 SBT Hóa học 10
15. Giải bài 39.15 trang 88 SBT Hóa học 10

Giải bài tập SBT Hóa 10 Bài 39: Luyện tập: Tốc độ phản ứng và cân bằng hóa học
1. Giải bài 39.1 trang 85 SBT Hóa học 10
Người ta đã sử dụng nhiệt của phản ứng đốt cháy than đá để nung vôi :
CaCO3(r) ⥩(to) CaO (r) + CO2 (r) ΔH > 0
Biện pháp kĩ thuật nào sau đây không được sử dụng để tăng tốc độ phản ứng nung vôi ?
A. Đập nhỏ đá vôi với kích thước thích hợp.
B. Duy trì nhiệt độ phản ứng thích hợp.
C. Tăng nhiệt độ phản ứng càng cao càng tốt.
D. Thổi không khí nén vào lò nung vôi.
Phương pháp giải
Xem lại lý thuyết về tốc độ phản ứng và cân bằng hóa học.
Hướng dẫn giải
Đáp án C
A. Đập nhỏ đá vôi với kích thước thích hợp ⇒ Tăng diện tích tiếp xúc
B. Duy trì nhiệt độ phản ứng thích hợp
C. Tăng nhiệt độ phản ứng càng cao càng tốt ⇒ Ảnh hưởng đến chất lượng vôi,…
D. Thổi không khí nén vào lò nung vôi ⇒ giảm nồng độ CO2
2. Giải bài 39.2 trang 86 SBT Hóa học 10
Trong những điều khẳng định sau, điều nào là phù hợp với một phản ứng hoá học ở trạng thái cân bằng ?
A. Phản ứng thuận đã kết thúc.
B. Phản ứng nghịch đã kết thúc.
C. Tốc độ của phản ứng thuận và nghịch bằng nhau.
D. Nồng độ của các chất tham gia và tạo thành sau phản ứng như nhau.
Phương pháp giải
Xem lại lý thuyết về tốc độ phản ứng và cân bằng hóa học.
Phản ứng hóa học ở trạng thái cân bằng thì tốc độ phản ứng nghịch bằng tốc độ phản ứng thuận
Hướng dẫn giải
Đáp án C
Tốc độ của phản ứng thuận và nghịch bằng nhau.
3. Giải bài 39.3 trang 86 SBT Hóa học 10
Để dập tắt một đám cháy thông thường, nhỏ, mới bùng phát người ta có thể
A. dùng vỏ chăn ướt trùm lên đám cháy.
B. dùng nước để dập tắt đám cháy.
C. dùng cát để dập tắt đám cháy.
D. Cả 3 phương án A, B, C.
Phương pháp giải
Xem lại lý thuyết về tốc độ phản ứng và cân bằng hóa học.
Hướng dẫn giải
Giải thích :Đối với đám cháy thông thường (chất cháy không phải xăng, dầu hay các kim loại...) có thể dùng một trong cả ba cách để dập tắt
- Chăn ướt ngăn khí oxi tiếp xúc với chất cháy đồng thời hạ thấp nhiệt độ xuống dưới điểm cháy
- Nước ngăn khí oxi tiếp xúc với chất cháy đồng thời hạ thấp nhiệt độ xuống dưới điểm cháy.
- Cát ngăn khí oxi tiếp xúc với chất cháy.
→ Chọn D
4. Giải bài 39.4 trang 86 SBT Hóa học 10
Đối với phản ứng có chất khí tham gia thì
A. khi áp suất tăng, tốc độ phản ứng giảm.
B. khi áp suất tăng, tốc độ phản ứng tăng.
C. khi áp suất giảm, tốc độ phản ứng tăng.
D. áp suất không ảnh hưởng đến tốc độ phản ứng
Phương pháp giải
Xem lại lý thuyết về tốc độ phản ứng và cân bằng hóa học.
Hướng dẫn giải
Đối với phản ứng có chất khí tham gia thì khi áp suất tăng, tốc độ phản ứng tăng.
→ Chọn B
5. Giải bài 39.5 trang 86 SBT Hóa học 10
Khi diện tích bề mặt tăng, tốc độ phản ứng tăng với phản ứng có chất ở trạng thái nào dưới đây tham gia ?
A. Trạng thái lỏng.
B. Trạng thái khí.
C. Trạng thái rắn.
D. Cả 3 trạng thái : lỏng, khí, rắn.
Phương pháp giải
Xem lại lý thuyết về tốc độ phản ứng và cân bằng hóa học.
Hướng dẫn giải
Khi diện tích bề mặt tăng, tốc độ phản ứng tăng với phản ứng có chất rắn
→ Chọn C
6. Giải bài 39.6 trang 86 SBT Hóa học 10
Cho 5 gam kẽm viên vào cốc đựng 50 ml dung dịch H2SO4 4M ở nhiệt độ thường (25°C). Trường hợp nào tốc độ phản ứng không thay đổi ?
A. Thay 5 gam kẽm viên bằng 5 gam kẽm bột.
B. Thay dung dịch H2SO4 4M bằng dung dịch H2SO4 2M.
C. Thực hiện phản ứng ở 50°C.
D. Dùng thể tích dung dịch H2SO4 4M gấp đôi ban đầu.
Phương pháp giải
Xem lại lý thuyết về tốc độ phản ứng và cân bằng hóa học
Hướng dẫn giải
D sai vì tăng thể tích sẽ làm tăng số mol của H2SO4 nên không ảnh hưởng đến tốc độ phản ứng.
→ Chọn D
7. Giải bài 39.7 trang 87 SBT Hóa học 10
Cho các phản ứng hoá học :
C(r) + H2O(k) ⇔ CO(k) + H2 (1)
2SO2 (k) + O2(k) ⇔ 2SO3(k) (2)
a) Hãy so sánh các đặc điểm của hai phản ứng hoá học trên.
b) Nêu các biện pháp kĩ thuật để làm tăng hiệu suất sản xuất.
Phương pháp giải
Xem lại lý thuyết về tốc độ phản ứng và cân bằng hóa học.
Hướng dẫn giải
a) So sánh các đặc điểm của hai phản ứng hoá học :
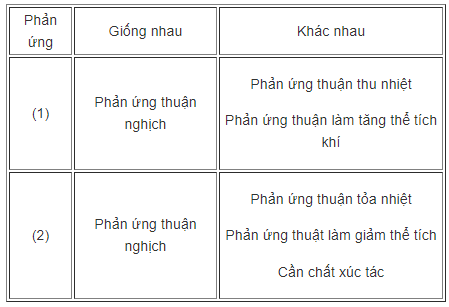
b) Các biện pháp kĩ thuật để làm tăng hiệu suất sản xuất:
- Đối với phản ứng (1): Tăng nhiệt độ, tăng nồng độ của hơi nước.
- Đối với phản ứng (2): Nếu giảm nhiệt độ, cân bằng chuyển sang chiều thuận, tuy nhiên ở nhiệt độ thấp tốc độ của phản ứng thấp làm cho quá trình sản xuất không kinh tế. Người ta chọn nhiệt độ thích hợp, dùng chất xúc tác V2O5và tăng áp suất chung của hệ phản ứng.
8. Giải bài 39.8 trang 87 SBT Hóa học 10
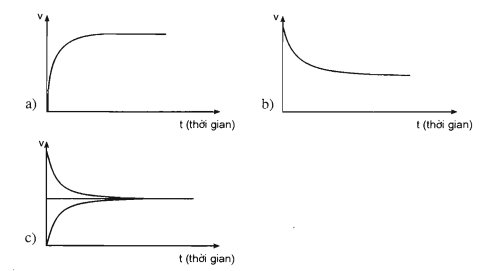
Đồ thị nào sau đây biểu diễn sự biến đổi tốc độ phản ứng thuận theo thời gian ? Sự biến đổi tốc độ phản ứng nghịch theo thời gian ? Trạng thái cân bằng hoá học ?
Phương pháp giải
Xem lại lý thuyết về tốc độ phản ứng và cân bằng hóa học.
Hướng dẫn giải
Đồ thị a biểu diễn sự biến đổi tốc độ phản ứng thuận theo thời gian.
Đồ thị b biểu diễn sự biến đổi tốc độ phản ứng nghịch theo thời gian.
Đồ thị c biểu diễn trạng thái cân bằng hoá học.
9. Giải bài 39.9 trang 87 SBT Hóa học 10
Vì sao không nển để than đá hay giẻ lau máy đã qua sử dụng thành một đống lớn ?
Phương pháp giải
Xem lại lý thuyết về tốc độ phản ứng và cân bằng hóa học.
Hướng dẫn giải
Phản ứng oxi hoá than đá (dầu, mỡ lau máy) ở nhiệt độ thường mặc dù diễn ra rất chậm, nhưng là phản ứng hoá học toả nhiệt. Nhiệt toả ra tích tụ lại làm tăng nhiệt độ của đống than (giẻ lau máy) đến điểm cháy, gây hoả hoạn rất nguy hiểm.
10. Giải bài 39.10 trang 87 SBT Hóa học 10
Trong vòng 100 năm qua, nhiệt độ trung bình của Trái Đất đã tăng thêm 0,6°C. Nguyên nhân chính của hiện tượng này là do sự tăng nồng độ khí cacbon đioxit (CO2) trong khí quyển, gây ra hiệu ứng nhà kính. Tương tự hiệu ứng giữ ấm cho thực vật trong các nhà kính trồng rau mùa đông ở vùng ôn đới.
Mặc dù lượng khí CO2 do công nghiệp thải ra hàng năm rất lớn, tăng nhanh, nhưng tại sao nồng độ của chất khí này trong khí quyển tăng chậm ?
Phương pháp giải
Xem lại lý thuyết về tốc độ phản ứng và cân bằng hóa học.
Hướng dẫn giải
Hai lí do chính:
Trong lòng biển và đại dương tồn tại cân bằng hoá học:
CaCO3 + H2O + CO2 ⇔ Ca(HCO3)2
Theo nguyên lí chuyển dịch cân bằng, khi nồng độ cacbon đioxit tăng thì cân bằng hoá học chuyển theo chiều thuận, do đó làm giảm nồng độ của cacbon đioxit.
- Sự quang hợp của cây xanh trên lục địa và của tảo ở biển và các đại dương:
6CO2 + 6H2O → C6H12O6 + 6O2
Dù cho có những quá trình tự điều tiết, khống chế sự tăng cacbon đioxit, nhưng con người đang thải lượng cacbon đioxit ngày càng nhiều hơn, vượt quá khả năng tự điều chỉnh của thiên nhiên.
11. Giải bài 39.11 trang 88 SBT Hóa học 10
Trong nước ngầm thường có ion Fe2+ dưới dạng muối sắt (II) hiđrocacbonat và sắt (II) hiđroxit. Nước sinh hoạt có chứa ion Fe2+ ảnh hưởng xấu đến sức khoẻ của con người. Để loại bỏ ion Fe2+ một cách đơn giản, rẻ tiền, người ta dùng oxi không khí oxi hoá ion Fe2+, thành hợp chất chứa ion Fe3+(ít tan trong nước) rồi lọc để thu nước sạch. Để tăng tốc độ của phản ứng oxi hoá ion Fe2+ người ta sử dụng biện pháp kĩ thuật nào ? Giải thích.
Phương pháp giải
Xem lại lý thuyết về tốc độ phản ứng và cân bằng hóa học.
Hướng dẫn giải
Để tăng tốc độ của phản ứng oxi hoá Fe2+, người ta sử dụng giàn mưa. Nước ngầm sau khi hút lên bể chứa được đưa qua giàn mưa với mục đích tăng diện tích tiếp xúc của nước với oxi không khí.
12. Giải bài 39.12 trang 88 SBT Hóa học 10
Gần đây, khi thám hiểm Nam Cực, các nhà khoa học đã tìm thấy những đồ hộp do các đoàn thám hiểm trước để lại. Mặc dù đã qua hàng trăm năm, nhưng các thức ăn trong những đồ hộp đó vẫn trong tình trạng tốt, có thể ăn được. Hãy giải thích và liên hệ với viộc bảo quản thực phẩm bằng cách ướp đá.
Phương pháp giải
Xem lại lý thuyết về tốc độ phản ứng và cân bằng hóa học, từ đó giải thích hiện tượng
Hướng dẫn giải
Nam Cực là nơi lạnh nhất Trái Đất. Nhiệt độ ở vùng này có thể xuống hàng chục độ dưới không. Ở nhiệt độ đó, các phản ứng hoá học phân huỷ thức ăn hầu như không xảy ra. Điều này giải thích vì sao đã qua hàng trăm năm, nhưng các thức ăn trong những đồ hộp đó vẫn trong tình trạng tốt, có thể ăn được. Để giảm tốc độ phản ứng phân huỷ thức ăn, người ta bảo quản thực phẩm bằng cách ướp đá.
13. Giải bài 39.13 trang 88 SBT Hóa học 10
Trong phòng thí nghiệm, để tăng tốc độ của một số phản ứng hoá học, ngoài các biện pháp như tăng nồng độ, nhiệt độ, người ta còn dùng máy khuấy. Tác dụng của máy khuấy là gì ?
Phương pháp giải
Xem lại lý thuyết về tốc độ phản ứng và cân bằng hóa học.
Dùng máy khuấy để tăng khả năng tiếp xúc của các chất và tăng tốc độ phản ứng hoá học
Hướng dẫn giải
Máy khuấy là một thiết bị cho phép tăng tốc độ khuếch tán của các chất tham gia phản ứng, do đó tăng khả năng tiếp xúc của các chất và tăng tốc độ phản ứng hoá học. Người ta thường dùng máy khuấy trong trường hợp phản ứng giữa các chất lỏng khác nhau, hay phản ứng giữa chất lỏng và chất rắn.
14. Giải bài 39.14 trang 88 SBT Hóa học 10
Làm thế nào để điều khiển các phản ứng hoá học theo hướng có lợi nhất cho con người ?
Phương pháp giải
Căn cứ vào đặc điểm của phản ứng để tác động theo hướng tăng tốc độ phản ứng, chuyển dịch cân bằng theo chiều có lợi nhất.
Hướng dẫn giải
Trước hết cần biết rõ đặc điểm của phản ứng hoá học:
+ Phản ứng một chiều hay thuận nghịch ?
+ Phản ứng thu nhiệt hay toả nhiệt ?
+ Phản ứng có sự tăng thể tích khí hay giảm thể tích khí ?
+ Phản ứng cần chất xúc tác hay không ?...
15. Giải bài 39.15 trang 88 SBT Hóa học 10
Nồng độ các chất tham gia phản ứng có ảnh hưởng như thế nào đến tốc độ phản ứng khi các chất sau đây tác dụng với nhau?
a) CaCO3 + HCl →
b) H2 + Cl2 →
c) Fe3O4 + H2 →
Phương pháp giải
Xem lại lý thuyết về tốc độ phản ứng và cân bằng hóa học.
Hướng dẫn giải
a) CaCO3 + 2HCl → CaCl2 + H2O + CO2
Khi dung dịch HCl có nồng độ càng lớn thì tốc độ phản ứng càng lớn.
b) H2 + Cl2 → 2HCl
Khi nồng độ (áp suất) các khí càng lớn thì tốc độ phản ứng càng lớn.
c) Fe3O4 + 4H2 → 3Fe + 4H2O
Chỉ có nồng độ (áp suất) của H2 ảnh hưởng đến tốc độ phản ứng vì Fe3O4 là chất rắn. Nồng độ (áp suất) của H2 tăng thì tốc độ phản ứng tăng
16. Giải bài 39.16 trang 88 SBT Hóa học 10
Cho phản ứng: 3O2 ↔ 2O3
Nồng độ ban đầu của O2 là 0,24 mol/lít, sau 5 giây, nồng độ của O2 còn là 0,02 mol/lít. Hãy tính tốc độ của phản ứng trong thời gian đó.
Phương pháp giải
Áp dụng biểu thức
V=ΔCMΔt
Hướng dẫn giải
Tốc độ phản ứng:
V = (0,04 - 0,02)/5 = 0,008 mol/s
17. Giải bài 39.17 trang 88 SBT Hóa học 10
Thực hiện phản ứng tổng hợp amoniac:
N2 + 3H2 ↔ 2NH3
Nồng độ mol ban đầu của các chất như sau :
[N2] = 1 mol/l ; [H2] = 1,2 mol/l
Khi phản ứng đạt cân bằng nồng độ mol của [NH3] = 0,2 mol/l. Tính hiệu suất của phản ứng tổng hợp amoniac.
Phương pháp giải
N2 + 3H2 ⇔ 2NH3
Theo PTHH thì 1 mol N2 cần 3 mol H2. Ở đây chỉ có 1,2 mol H2, vì H2 thiếu nên tác dụng hết. Hiệu suất phải tính theo lượng chất tác dụng hết.
Xét giai đoạn ban đầu và cân bằng
Hướng dẫn giải
N2 + 3H2 ⇔ 2NH3
Ban đầu: 1 mol/l 1,2 mol/l
Cân bằng: 0,3 mol/l 0,2 mol/l
Theo PTHH thì 1 mol N2 cần 3 mol H2. Ở đây chỉ có 1,2 mol H2, vì H2 thiếu nên tác dụng hết. Hiệu suất phải tính theo lượng chất tác dụng hết. Số mol H2 đã tác dụng là 0,3 mol.
Vậy H = (0,3 : 1,2). 100 = 25%
Tham khảo thêm
- doc Giải bài tập SBT Hóa 10 Bài 36: Tốc độ phản ứng hóa học
- doc Giải bài tập SBT Hóa 10 Bài 38: Cân bằng hóa học




