Hoá học 11 Bài 39: Dẫn xuất halogen của hiđrocacbon
Nội dung bài giảng Dẫn xuất halogen của hiđrocacbon tìm hiểu về khái niệm, phân loại dẫn xuất halogen; Tính chất hóa học đặc trưng của một số dẫn xuất halogen; Hoạt tính sinh học và ứng dụng của một số dẫn xuất halogen; giúp học sinh hiểu: Phản ứng thế nguyên tử halogen (trong phân tử ankyl halogenua, anlyl halogenua, phenyl halogenua) bằng nhóm –OH.
Mục lục nội dung

Hoá học 11 Bài 39: Dẫn xuất halogen của hiđrocacbon
1. Tóm tắt lý thuyết
1.1. Khái niệm, phân loại
a. Khái niệm
Khi thay thế nguyên tử hidro của phân tử hidrocacbon bằng nguyên tử halogen ta được dẫn xuất halogen của hidrocacbon.
- Hidrocacbon: CH4, CH2=CH2, C6H6
- Dẫn xuất halogen: CH3Cl, CH3Br, CH2Cl2, CH2ClF, CH2=CH2-Cl, C6H5Br
Thay thế nhóm -OH trong phân tử ancol bằng nguyên tử Halogen
C2H5OH + HBr → C2H5Br + H2O
Cộng hợp hidro halogenua hoặc halogen vào phân tử hidrocacbon không no.
CH2=CH2 + HBr → CH3-CH2-Br
CH2=CH2 + Br2 → CH2Br-CH2Br
Thế nguyên tử hidro của hidrocacbon bằng nguyên tử halogen
CH4 + Cl2 → CH3Cl + HCl (Điều kiện: ánh sáng)
b. Phân loại
- Các dẫn xuất halogen được phân loại dựa vào bản chất của halogen,số lượng nguyên tử halogen và đặc điểm cấu tạo của hidrocacbon
- Một số koại dẫn xuất halogen thường gặp:
+ Dẫn xuất halogen của hidrocacbon no, mạch hở. VD: CH3Cl (metyl clorua); CH2Cl-CH2Cl (1, 2- đicloetan)
+ Dẫn xuất halogen của hidrocacbon không no, mạch hở. VD: CH2=CHCl
+ Dẫn xuất của hidrocacbon thơm. VD: C6H5Br (Phenyl bromua)
- Bậc của dẫn xuất halogen bằng bậc của nguyên tử C liên kết với nguyên tử halogen
Bậc I: CH3-C(I)H2Cl (Etyl clorua)
Bậc II: CH3-C(II)HCl-CH3 (isopropyl clorua)
Bậc III: (CH3)3C(III)-Br (tert-butyl bromua)
1.2. Tính chất vật lí
Ở điều kiện thường, một số chất có phân tử khối nhỏ (CH3Cl, CH3F, ...) ở trạng thái khí. Các dẫn xuất có phân tử khối lớn hơn ở trạng thái lỏng và rắn.
Hầu như không tan trong nước, tan tốt trong các dung môi hữu cơ như hidrocacbon, ete, ...
Một số dẫn xuất halogen có hoạt tính sinh học cao như CF3-CHClBr (halotan: chất gây mê, không độc), DDT (thuốc diệt côn trùng)
1.3. Tính chất hoá học
a. Phản ứng thế nguyên tử halogen bằng nhóm –OH
Phương trình tổng quát: R-X + NaOH → R-OH + NaX
Đun nhẹ hỗn hợp etyl bromua trong dung dịch NaOH, đồng thời lắc đều. Sau một thời gian thu được hỗn hợp đồng nhất, do đã xảy ra phản ứng:
CH3-CH2-Br + NaOH → C2H5OH + NaBr
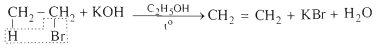
b. Phản ứng tách hidrohalogennua
Đun sôi hỗn hợp gồm etyl bromua, kali hidroxit và etanol thấy có khí không màu thoát ra:
1.4. Ứng dụng
a. Làm nguyên liệu cho tổng hợp hữu cơ
Vinylclorua tổng hợp nhựa PVC

Hình 1: Ống PVC và ống PVC màu
Isopren tổng hợp cao su Isopren
CF2=CF2 tổng hợp tefon

Hình 2: Dụng cụ nấu ăn chống dính
Tổng hợp ancol, phenol…
b. Làm dung môi
Clorofom ; 1,2- đicloetan…
c. Các lĩnh vực khác
Thuốc trừ sâu, diệt côn trùng, thuốc gây mê
1.5. Tổng kết
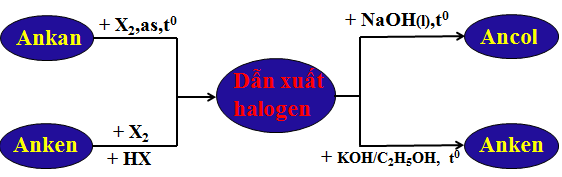
Hình 3: Sơ đồ tư duy bài Dẫn xuất halogen
2. Bài tập minh họa
2.1. Dạng 1: Cách viết đồng phân, gọi tên dẫn xuất halogen
Bài 1: Viết các đồng phân của C4H9Cl và gọi tên?
Hướng dẫn giải
Đồng phân của C4H9Cl:
CH3-CH2-CH2-CH2-Cl (1-clo butan);
CH3-CH2-CH(Cl)-CH3 (2-clobutan);
CH3-CH(CH3)-CH2-Cl (1-clo-2-metylpropan);
CH3-CH2-CH(CH3)-Cl (1-clo-1-metyl propan);
CH3-C(CH3)(Cl)-CH3 (2-clo-2-metyl propan)
Bài 2: Viết CTCT của các chất sau:
(1) 1,3-điclo-2-metylbutan.;
(2) benzyl clorua.
(3) isopropyl clorua;
(4) 1,1-đibrometan ;
(5) anlyl clorua.
Hướng dẫn giải
(1) CH3-CH(Cl)-CH(CH3)-CH2Cl;
(2) C6H5CH2Cl;
(3) CH3-CH(CH3)Cl;
(4) CH2(Cl)2;
(5) CH2=CH-CH2-Cl
2.2. Dạng 2: Thủy phân dẫn xuất halogen (Thế nguyên tử Halogen bằng –OH)
Bài 1 : Đun nóng 1,91 gam hỗn hợp X gồm C3H7Cl và C6H5Cl với dung dịch NaOH loãng vừa đủ, sau đó thêm tiếp dung dịch AgNO3 đến dư vào hỗn hợp sau phản ứng, thu được 1,435 gam kết tủa. Khối lượng C6H¬5Cl trong hỗn hợp đầu là?
A. 1,125 gam.
B. 1,570 gam.
C. 0,875 gam.
D. 2,250 gam.
Hướng dẫn giải
Căn cứ vào các tính chất của các halogen ta thấy chỉ có C3H7Cl phản ứng được với dung dịch NaOH đun nóng.
Phương trình phản ứng :
C3H7Cl + NaOH → C3H7OH + NaCl (1)
x x (mol)
AgNO3 + NaCl → AgCl + NaNO3 (2)
x x (mol)
nC3H7Cl = nNaCl = nAgCl = 1,435/143,5 =0,01 mol
→ mC6H5Cl = 1,91 - 0,01 .78,5 = 1,1125 gam.
⇒ Đáp án A.
Bài 2: Hỗn hợp X gồm 0,1 mol anlyl clorua ; 0,3 mol benzyl bromua ; 0,1 mol hexyl clorua ; 0,15 mol phenyl bromua. Đun sôi X với nước đến khi phản ứng xảy ra hoàn toàn, chiết lấy phần nước lọc, rồi cho tác dụng với dung dịch AgNO3 dư thu được m gam kết tủa. Giá trị của m là :
A. 28,7.
B. 57,4.
C. 70,75.
D. 14,35.
Hướng dẫn giải
Khi đun sôi hỗn hợp X trong nước thì chỉ có anlyl clorua và benzyl bromua bị thủy phân.
Phương trình phản ứng :
C6H5CH2Br + H2O → C6H5CH2OH + HBr (1)
0,3 → 0,3 (mol)
CH2=CH–CH2Cl + H2O → CH2=CH–CH2OH + HCl (2)
0,1 → 0,1 (mol)
AgNO3 + HBr → AgBr + HNO3 (3)
0,3 ← 0,3
AgNO3 + HCl → AgCl + HNO3 (4)
0,1 ← 0,1 (mol)
Theo các phương trình phản ứng và giả thiết ta có :
m = 0,3.188 + 0,1.143,5 = 70,75 gam.
⇒ Đáp án C.
2.3. Dạng 3: Phản ứng tách HX
Đun sôi 15,7 gam C3H7Cl với hỗn hợp KOH/C2H5OH dư, sau khi loại tạp chất và dẫn khí sinh ra qua dung dịch brom dư thấy có x gam Br2 tham gia phản ứng. Tính x nếu hiệu suất phản ứng ban đầu là 80%.
A. 25,6 gam.
B. 32 gam.
C. 16 gam.
D. 12,8 gam.
Hướng dẫn giải
nC3H7Cl = 0,2 mol;
Phương trình phản ứng :
C3H7Cl to→ C3H6 + HCl (1)
0,2.80% 0,16 (mol) (H=80%)
C3H6 + Br2 → C3H6Br2 (2)
0,16 0,16 (mol)
Theo các phản ứng và giả thiết ta có: x = 0,16.160 = 25,6 gam.
⇒ Đáp án A.
3. Luyện tập
3.1. Bài tập tự luận
Câu 1: Đun nóng 13,875 gam một ankyl clorua Y với dung dịch NaOH, tách bỏ lớp hữu cơ, axit hóa phần còn lại bằng dung dịch HNO3, nhỏ tiếp vào dd AgNO3 thấy tạo thành 21,525 gam kết tủa. Xác định CTPT của Y?
Câu 2: Cho 54,5 g một ankyl clorua X tác dụng với dung dịch KOH trong C2H5OH đun nóng nhẹ, thu được V lít khí Y và 7,45 g muối Z.
a. Xác định ankyl clorua
b. Tính thể tích khí thoát ra?
Câu 3: Đun nóng 27,40 gam CH3CHBrCH2CH3 với KOH dư trong C2H5OH, sau khi phản ứng xảy ra hoàn toàn thu được hỗn hợp khí X gồm hai olefin trong đó sản phẩm chính chiếm 80%, sản phẩm phụ chiếm 20%. Đốt cháy hoàn toàn X thu được bao nhiêu lít CO2 (đktc) ? Biết các phản ứng xảy ra với hiệu suất phản ứng là 100%.
Câu 4: Đun nóng 1,91 gam hỗn hợp X gồm C3H7Cl và C6H5Cl với dung dịch NaOH loãng vừa đủ, sau đó thêm tiếp dung dịch AgNO3 đến dư vào hỗn hợp sau phản ứng, thu được 1,435 gam kết tủa. Khối lượng C6H5Cl trong hỗn hợp đầu là?
Câu 5: Hỗn hợp X gồm 0,1 mol anlyl clorua; 0,3 mol benzyl bromua; 0,1 mol hexyl clorua ; 0,15 mol phenyl bromua. Đun sôi X với nước đến khi phản ứng xảy ra hoàn toàn, chiết lấy phần nước lọc, rồi cho tác dụng với dung dịch AgNO3 dư thu được m gam kết tủa. Giá trị của m là?
3.2. Bài tập trắc nghiệm
Câu 1: Đun sôi 15,7 gam C3H7Cl với hỗn hợp KOH/C2H5OH dư, sau khi loại tạp chất và dẫn khí sinh ra qua dung dịch brom dư thấy có x gam Br2 tham gia phản ứng. Tính x nếu hiệu suất phản ứng ban đầu là 80%.
A. 25,6 gam.
B. 32 gam.
C. 16 gam.
D. 12,8 gam.
Câu 2: Sản phẩm chính của phản ứng tách HBr của CH3CH(CH3)CHBrCH3 là :
A. 2-metylbut-2-en.
B. 3-metylbut-2-en.
C. 3-metyl-but-1-en.
D. 2-metylbut-1-en.
Câu 3: Sản phẩm chính tạo thành khi cho 2-brombutan tác dụng với dung dịch KOH/ancol, đun nóng là:
A. Metylxiclopropan.
B. But-2-ol.
C. But-1-en.
D. But-2-en.
Câu 4: Cho hợp chất thơm: ClC6H4CH2Cl + dung dịch KOH (đặc, dư, to, p) ta thu được chất nào?
A. KOC6H4CH2OK.
B. HOC6H4CH2OH.
C. ClC6H4CH2OH.
D. KOC6H4CH2OH.
Câu 5: Chất nào là dẫn xuất halogen của hiđrocacbon?
A. Cl – CH2 – COOH
B. C6H5 – CH2 – Cl
C. CH3 – CH2 – Mg – Br
D. CH3 – CO – Cl
3.3. Trắc nghiệm Online
Các em hãy luyện tập bài trắc nghiệm Dẫn xuất halogen của hiđrocacbon Hóa học 11 sau để nắm rõ thêm kiến thức bài học.
4. Kết luận
Sau bài học cần nắm:
- Khái niệm, phân loại dẫn xuất halogen
- Tính chất hóa học đặc trưng của một số dẫn xuất halogen
- Hoạt tính sinh học và ứng dụng của một số dẫn xuất halogen
Tham khảo thêm
- doc Hoá học 11 Bài 40: Ancol
- doc Hoá học 11 Bài 41: Phenol
- doc Hoá học 11 Bài 42: Luyện tập Dẫn xuất halogen, ancol, phenol
- doc Hoá học 11 Bài 43: Bài thực hành 5 Tính chất của etanol, glixerol và phenol




