Hóa học 9 Bài 4: Một số axit quan trọng
Nội dung bài học giúp học sinh biết về các tính chất hóa học của axit HCl, H2SO4 loãng: Biết được cách viết phương trình phản ứng thể hiện tính chất chung của axit. Đồng thời, H2SO4 đặc có những tính chất hoá học riêng: Tính oxi hoá (tác dụng với những kim loại kém hoạt động) tính háo nước, dẫn ra được những phản ứng minh họa cho những tính chất này. Những ứng dụng quan trọng của axit trong sản xuất, trong đời sống.
Mục lục nội dung

1. Tóm tắt lý thuyết
1.1. Axit clohiđric
a. Tính chất hóa học
HCl có đầy đủ tính chất hóa học của axit
- Làm quỳ tím chuyển sang màu đỏ
- Tác dụng với kim loại: 2Al ( r) + 6HCl (dd) → 2 AlCl3 (dd) + 3H2 (k)
- Tác dụng với bazơ: Cu(OH)2(r)+2HCl(dd) → CuCl2(dd)+ 2H2O(l)
- Tác dụng với oxit bazơ: CuO (r) + 2HCl (dd) → CuCl2(dd) + H2O
- Tác dụng với muối: (Học trong bài 9)
b. Ứng dụng
- Điều chế các muối.
- Làm sạch bề mặt kim loại trước khi hàn.
- Tẩy gỉ kim loại trước khi tráng, sơn, mạ kim loại .
- Chế biến thực phẩm, dược phẩm.
1.2. Axit sunfuric (H2SO4)
a. Tính chất vật lí
Chất lỏng sánh, không màu, nặng gấp đôi nước, không bay hơi, dễ tan trong nước, toả rất nhiều nhiệt
Lưu ý: Khi pha H2SO4 loãng, ta cho từ từ axit vào lọ nước (không làm ngược lại vì nguy hiểm)
b. Tính chất hóa học
- Axit H2SO4 loãng (H2SO4)
- Làm quỳ tím hoá đỏ
- Tác dụng với kim loại → muối + nước
Mg + H2SO4l → MgSO4 + H2
- Tác dụng với bazơ → muối + nước
H2SO4l + Cu(OH)2 → CuSO4 + 2H2O
- Tác dụng với oxit bazơ → muối + nước
3H2SO4l + Fe2O3 → Fe2(SO4)3 + 3H2O
- Tác dụng với muối
- Axit sunfuric đặc có những tính chất hóa học riêng
- Tác dụng với kim loại
H2SO4 đặc, nóng tác dụng được với đồng, tạo khí SO2 không màu, mùi hắc; dung dịch CuSO4 màu xanh lam.
Phương trình phản ứng: Cu + 2H2SO4 (đ) \(\xrightarrow{{{t^0}}}\) CuSO4 + SO2 + 2H2O
Nhận xét: H2SO4 đặc tác dụng với nhiều kim loại khác → muối sunfat, không giải phóng khí H2
- Tính háo nước
C12H22O11 \(\xrightarrow{{{H_2}S{O_4}d}}\) 11H2O + 12C
c. Ứng dụng
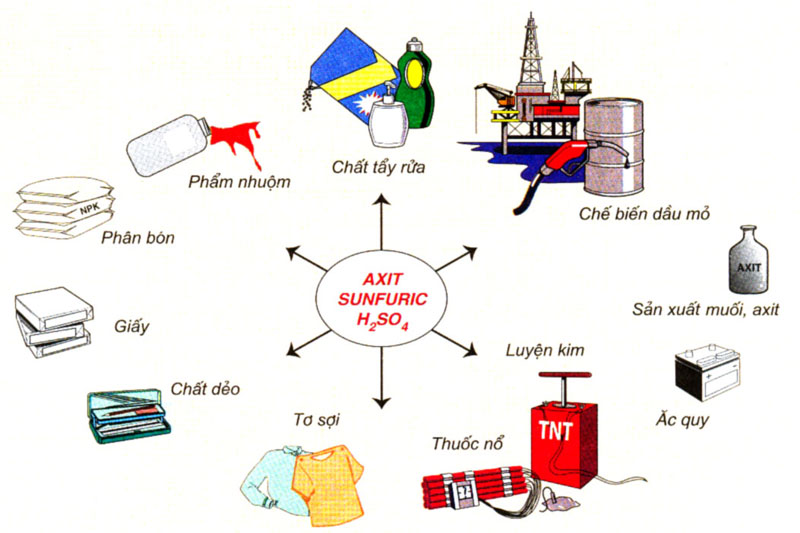
d. Sản xuất axit sunfuric
- Nguyên liệu: Lưu huỳnh hoặc Quặng Pyritsắt (FeS2)
- Các công đoạn chính:
- Sản xuất lưu huỳnh đioxit:
S + O2 \(\xrightarrow{{{t^0}}}\) SO2
Hoặc 4FeS2 + 11O2 \(\xrightarrow{{{t^0}}}\) 2Fe2O3 + 8SO2
- Sản xuất lưu huỳnh trioxit:
2SO2 + O2 \(\xrightarrow{{{t^0},{V_2}{O_5}}}\) 2SO3
- Sản xuất H2SO4:
SO3 + H2O → H2SO4
e. Nhận biết axit sunfuric và muối sunfat
- Dung dịch BaCl2; Ba(NO3)2 ; Ba(OH)2 được dùng làm thuốc thử để nhận ra gốc sunfat
- Gốc =SO4 trong phân tử H2SO4 kết hợp với nguyên tố bari trong phân tử BaCl2 tạo thành kết tủa BaSO4
- Phương trình hóa học: H2SO4 + BaCl2 → BaSO4 + 2HCl
1.3. Tổng kết
.png)
2. Bài tập minh họa
2.1. Dạng 1: Viết phương trình hóa học tính chất hóa học của axit
Cần phải điều chế một lượng đồng (II) sunfat. Phương pháp nào sau đây tiết kiệm được axit sunfuric?
a. Axit sunfuric tác dụng với đồng (II) oxit.
b. Axit sunfuric đặc tác dụng với đồng kim loại.
Viết các phương trình hóa học và giải thích.
Hướng dẫn giải
a. Phương trình hóa học CuO + H2SO4 → CuSO4 + H2O
b. Phương trình hóa học Cu + 2H2SO4 (đ) \(\xrightarrow{{{t^0}}}\) CuSO4 + SO2 + 2H2O
Ở phản ứng a tỉ lệ phản ứng của Cu : H2SO4 là 1: 1 nên sẽ tiết kiệm được axit hơn phản ứng b theo tỉ lệ 1:2.
Hơn nữa ở phản ứng 2 tạo thêm sản phẩm SO2 là khí độc, mùi hắc là nguyên nhân chính tạo ra mưa axit gây ô nhiễm môi trường.
2.2. Dạng 2: Bài tập nhận biết
Có 4 lọ không nhãn đựng 4 dung dịch không màu là: HCl, H2SO4, NaCl, Na2SO4. Hãy nhận biết dung dịch trong mỗi lọ bằng phương pháp hóa học. Viết các phương trình hóa học.
Hướng dẫn giải
Trích dẫn một ít dung dịch của 4 chất để làm mẫu thử rồi lần lượt tiến hành lần lượt như sau:
|
Thuốc thử |
HCl |
H2SO4 |
NaCl |
Na2SO4 |
|
Qùy tím |
Đỏ |
Đỏ |
- |
- |
|
Dung dịch BaCl2 |
- |
Kết tủa trắng |
- |
Kết tủa trắng |
- Dung dịch nào làm quỳ tím hóa đỏ, và không hiện tượng với dung dịch BaCl2 là dung dịch HCl
- Dung dịch nào làm quỳ tím hóa đỏ, và có kết tủa trắng với dung dịch BaCl2 là dung dịch H2SO4
- Dung dịch nào không làm đổi màu quỳ tím, và không hiện tượng với dung dịch BaCl2 là dung dịch NaCl
- Dung dịch nào không làm đổi màu quỳ tím, và có kết tủa trắng với dung dịch BaCl2 là dung dịch Na2SO4
2.3. Dạng 3: Xác định khối lượng các chất tham gia hoặc sản phẩm
Trung hòa 300ml dung dịch H2SO4 1,5M bằng dung dịch NaOH 40%
a. Tính khối lượng dung dịch NaOH cần dùng.
b. Nếu thay dung dịch NaOH bằng dung dịch KOH 5,6% (D = 1,045g/ml) thì lượng KOH cần dùng là bao nhiêu?
Hướng dẫn giải
a. Phương trình hóa học: H2SO4 + 2NaOH → Na2SO4 + 2H2O
Số mol H2SO4 là: nH2SO4 = 0,3 . 1,5 = 0,45 mol
Khối lượng NaOH cần dùng: mNaOH = 2. 0,45. 40 = 36 (g).
Khối lượng dung dịch NaOH 40%: mdd = 36.10040 = 90 (g).
b. Phương trình phản ứng: H2SO4 + 2KOH → K2SO4 + 2 H2O
Khối lượng KOH cần dùng: mKOH = 2 . 0,45 . 56 = 50,4 (g).
Khối lượng dung dịch KOH: mdd = 50,4.1005,6 = 900 (g).
Thể tích dung dịch KOH cần dùng: Vdd = mdd.D = 9001,045 = 861,2 ml.
3. Luyện tập
3.1. Bài tập tự luận
Câu 1: Cho một lượng bột sắt dư vào 50 ml dung dịch axit sunfuric. Phản ứng xong, thu được 3,36 lít khí hiđro (đktc).
a) Viết phương trình hoá học.
b) Tính khối lượng sắt đã tham gia phản ứng.
c) Tính nồng độ moi của dung dịch axit sunfuric đã dùng.
Câu 2: Có 3 lọ không nhãn, mỗi lọ đựng một trong những chất rắn sau: CuO, BaCl2, Na2CO3. Hãy chọn một thuốc thử để có thể nhận biết được cả ba chất trên. Giải thích và viết phương trình hoá học.
Câu 3: Hãy sử dụng những chất có sẵn: Cu, Fe, CuO, KOH, C6H12O6 (glucozơ), dung dịch H2SO4 loãng, H2SO4 đặc và những dụng cụ thí nghiệm cần thiết để làm những thí nghiệm chứng minh rằng:
a) Dung dịch H2SO4 loãng có những tính chất chung của axit.
b) H2SO4 đặc có những tính chất hóa học riêng.
Viết phương trình hóa học cho mỗi thí nghiệm.
3.2. Bài tập trắc nghiệm
Câu 1: Để an toàn khi pha loãng H2SO4 đặc cần thực hiện theo cách:
A. Rót từng giọt nước vào axit.
B. Rót từng giọt axit vào nước.
C. Cho cả nước và axit vào cùng một lúc.
D. Cả 3 cách trên đều được.
Câu 2: Dung dịch axit clohiđric tác dụng với sắt tạo thành:
A. Sắt (II) clorua và khí hiđrô.
B. Sắt (III) clorua và khí hiđrô.
C. Sắt (II) Sunfua và khí hiđrô.
D. Sắt (II) clorua và nước.
Câu 3: Dung dịch axit clohiđric tác dụng với đồng (II) hiđrôxit tạo thành dung dịch màu:
A. Vàng đậm
B. Đỏ
C. Xanh lam
D. Da cam
Câu 4: Oxit tác dụng được với axit clohiđric là:
A. SO2
B. CO2
C. CuO
D. CO
Câu 5: Axit sunfuric đặc nóng tác dụng với đồng kim loại sinh ra khí:
A. CO2
B. SO2
C. SO3
D. H2S
Câu 6: Khi nhỏ từ từ H2SO4 đậm đặc vào đường chứa trong cốc hiện tượng quan sát được là:
A. Sủi bọt khí, đường không tan.
B. Màu trắng của đường mất dần, không sủi bọt.
C. Màu đen xuất hiện và có bọt khí sinh ra.
D. Màu đen xuất hiện, không có bọt khí sinh ra.
4. Kết luận
Sau bài học cần nắm:
- Biết được cách viết phương trình phản ứng thể hiện tính chất chung của axit.
- H2SO4 đặc có những tính chất hoá học riêng: Tính oxi hoá (tác dụng với những kim loại kém hoạt động) tính háo nước, dẫn ra được những phản ứng minh họa cho những tính chất này.
- Những ứng dụng quan trọng của axit trong sản xuất, trong đời sống.
Tham khảo thêm
- docx Hoá học 9 Bài 1: Tính chất hóa học của oxit và Khái quát về sự phân loại oxit
- docx Hóa học 9 Bài 2: Một số oxit quan trọng
- docx Hóa học 9 Bài 3: Tính chất hóa học của axit
- docx Hóa học 9 Bài 5: Luyện tập tính chất hóa học của oxit và axit
- docx Hóa học 9 Bài 6: Thực hành: Tính chất hóa học của oxit và axit
- docx Hóa học 9 Bài 7: Tính chất hóa học của bazơ
- docx Hóa học 9 Bài 8: Một số bazơ quan trọng
- docx Hóa học 9 Bài 9: Tính chất hóa học của muối
- doc Hóa học 9 Bài 10: Một số muối quan trọng
- docx Hóa học 9 Bài 11: Phân bón hóa học
- docx Hóa học 9 Bài 12: Mối quan hẹ giữa các loại hợp chất vô cơ
- docx Hóa học 9 Bài 13: Luyện tập chương 1 Các loại hợp chất vô cơ
- docx Hóa học 9 Bài 14: Thực hành: Tính chất hóa học của bazơ và muối



