Hóa học 9 Bài 8: Một số bazơ quan trọng
Nội dung bài học nghiên cứu về các vấn đề: Natri hiđroxit NaOH và Canxi hiđroxit Ca(OH)2 có những tính chất vật lí, tính chất hóa học nào? Những ứng dụng trong đời sống và sản xuất gồm những gì?
Mục lục nội dung

1. Tóm tắt lý thuyết
1.1. Natri hiđroxit
a. Tính chất vật lí

- NaOH là chất rắn không màu, hút ẩm mạnh, tan nhiều trong nước và tỏa nhiệt.
- Dung dịch NaOH có tính nhờn làm bục vải, giấy và ăn mòn da.
b. Tính chất hóa học
NaOH là bazơ tan và có các tính chất hóa học của một bazơ tan:
- Đổi màu chất chỉ thị
Dung dịch NaOH làm quì tím chuyển sang màu xanh, phenolphtalein không màu thành màu đỏ.
- Tác dụng với axit
Dung dịch NaOH tác dụng với axit tạo thành muối và nước.
NaOH + HCl → NaCl + H2O
NaOH + HNO3 → NaNO3 + H2O
- Tác dụng với oxit axit
Dung dịch NaOH tác dụng với oxit axit tạo thành muối và nước.
Một số phương trình phản ứng:
2NaOH + CO2 → Na2CO3 + H2O
NaOH + CO2 → NaHCO3
2NaOH + SO2 → Na2SO3 + H2O
- Tác dụng với dung dịch muối
(Sẽ được trình bày cụ thể ở bài 9)
c. Ứng dụng của NaOH
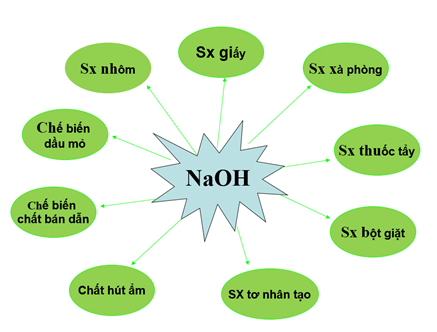
d. Sản xuất natri hiđroxit
- NaOH được điều chế bằng cách điện phân dung dịch NaCl.
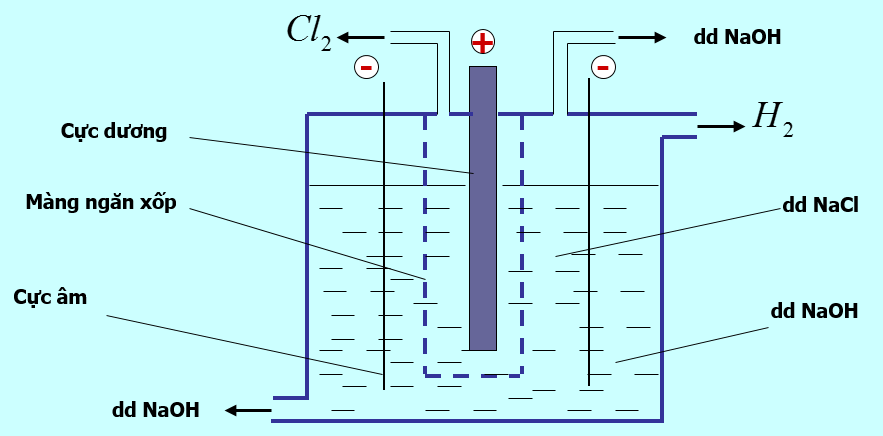
- Tác dụng của màng ngăn xốp: Không cho khí Hiđro và clo tác dụng với nhau (không có màng ngăn xốp không thu được NaOH) H2 + Cl2 → 2HCl
- Phương trình phản ứng:
2NaCl + 2H2O (Điện phân dung dịch, có màng ngăn) → 2NaOH + H2 + Cl2
1.2. Canxi Hiđroxit- Thang pH
a. Pha chế dung dịch canxi hiđroxit
Bước 1: ta lấy canxi hiđroxit cho vào nước khuấy đều.
Bước 2: dùng giấy lọc, để lọc lấy chất lỏng trong suốt, không màu là dung dịch canxi hiđroxit (nước vôi trong).
2.png)
b. Tính chất hóa học
- Làm đổi màu chất chỉ thị
Dung dịch Ca(OH)2 đổi màu quỳ tím thành xanh, hoặc đổi màu dd phenolptalein không màu thành màu hồng.
- Tác dụng với axit (tạo muối và nước)
Phương trình hóa học:
H2SO4 + Ca(OH)2 → CaSO4 + 2H2O
HCl + Ca(OH)2 → CaCl2 + 2H2O
- Tác dụng với oxit axit (tạo muối + nước)
Tuỳ theo tỉ lệ số mol của Ca(OH)2 với số SO2 mà có thể tạo muối trung hoà và nước, muối axit hoặc cả hai muối.
Phương trình hóa học:
Ca(OH)2 + SO2 → CaSO3 + H2O
Ca(OH)2 + 2SO2 → Ca(HSO3)2
- Tác dụng với dung dịch muối (Học ở bài 9)
c. Ứng dụng của canxi hiđroxit
- Làm vật liệu xây dựng.
- Khử chua đất trồng trọt.
- Khử độc các chất thải trong công nghiệp, diệt trùng chất thải sinh hoạt và xác chết động vật.
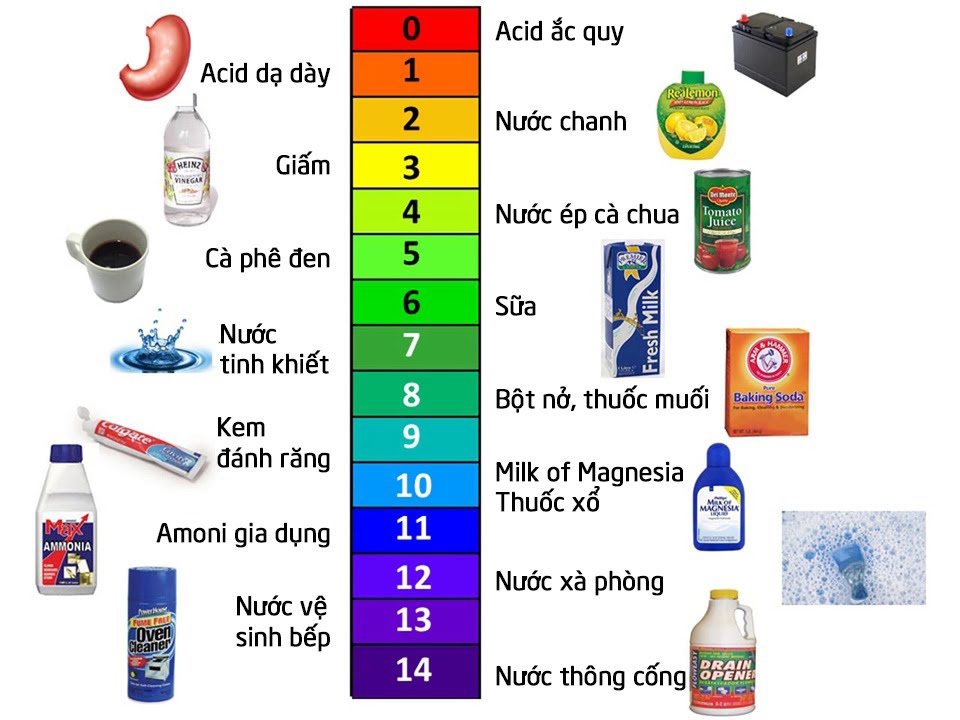
d. Thang pH
- Thang pH dùng để biểu thị độ axit hoặc độ bazơ của dung dịch.
- Nếu pH = 7 thì dung dịch là trung tính.
- Nếu pH > 7 thì dung dịch có tính bazơ ⇒ Nếu pH càng lớn, độ bazơ của dung dịch càng lớn và ngược lại.
- Nếu pH < 7 thì dung dịch có tính axit ⇒ Nếu pH càng nhỏ, độ axit của dung dịch càng lớn và ngược lại.
2. Bài tập minh họa
2.1. Dạng 1: Viết phương trình hóa học tính chất của bazơ
Hoàn thành sơ đồ chuyển hóa sau:
Na2O → NaOH → Na2SO4 → BaSO4
Hướng dẫn giải
Na2O + H2O → 2NaOH
2NaOH + H2SO4 → Na2SO4 + 2H2O
Hoặc : 2NaOH + SO3 → Na2SO4 + 2H2O
Na2SO4 + BaCl2 → BaSO4 + 2NaCl
Hoặc : Na2SO4 + Ba(NO3)2 → BaSO4 + 2NaNO3
Hoặc : Na2SO4 + Ba(OH)2 → BaSO4 + 2NaOH
2.2. Dạng 2: Bài tập CO2 tác dụng với dung dịch kiềm
Câu 1: Dẫn V lit CO2 (đktc) vào dung dịch chứa 3,7 gam Ca(OH)2. Sau phản ứng thu được 4 gam kết tủa. Tính V?
Hướng dẫn giải
Theo bài ra ta có:
Số mol của Ca(OH)2 = 3,7 / 74 = 0,05 mol
Số mol của CaCO3 = 4 / 100 = 0,04 mol
Phương trình hóa học:
CO2 + Ca(OH)2 → CaCO3 + H2O
Nếu CO2 không dư:
Ta có số mol CO2 = số mol CaCO3 = 0,04 mol
Vậy V(đktc) = 0,04 . 22,4 = 0,896 lít
Nếu CO2 dư:
CO2 + Ca(OH)2 → CaCO3 + H2O
0,05 ← 0,05 mol → 0,05
CO2 + CaCO3 + H2O → Ca(HCO3)2
0,01 ← (0,05 - 0,04) mol
Vậy tổng số mol CO2 đã tham gia phản ứng là: 0,05 + 0,01 = 0,06 mol
V(đktc) = 22,4 . 0,06 = 1,344 lít
Câu 2: Hấp thụ hoàn toàn 0,16 mol CO2 vào 2 lít dd Ca(OH)2 0,05 M thu được kết tủa X và dd Y. Cho biết khối lượng dd Y tăng hay giảm bao nhiêu so với dd Ca(OH)2 ban đầu?
Hướng dẫn giải
CO2 + Ca(OH)2 → CaCO3 + H2O
0,1 0,1 0,1
2CO2 + CaCO3 + H2O → Ca(HCO3)2
0,16 – 0,1 → 0,06
→ n↓= 0,04 mol
Khối lượng kết tủa tạo thành là:
m ↓ = 4 gam < 0,16 . 44 = 7,04 gam
→ mdd tăng = 7,04 – 4 = 3,04 gam
2.3. Dạng 3: Bài tập nhận biết
Bằng phương pháp hóa học hãy phân biệt: NaOH, HCl, Na2SO3, Na2SO4, NaNO3.
Hướng dẫn giải
- Phân tích: NaOH là bazơ; HCl là axit; Na2SO3 muối của gốc axit yếu; Na2SO4, NaNO3 là muối của gốc axit mạnh.
- Cách nhận biết:
- Lấy mỗi chất một ít làm mẫu thử. Mỗi lần làm thí nghiệm thay mẫu thử mới. Cho HCl vào các mẫu thử. Mẫu sủi bọt khí là Na2SO3.
Na2SO3 + 2HCl → 2NaCl + SO2 ↑+ H2O
- Cho quì tím vào các mẫu còn lại: Mẫu làm quì tím hóa đỏ là HCl, mẫu làm quì tím hóa xanh là NaOH.
- Cho dung dịch BaCl2 vào các mẫu còn lại. Mẫu xuất hiện kết tủa trắng là Na2SO4.
BaCl2 + Na2SO4 → BaSO4 ↓+ 2NaCl
- Mẫu còn lại không có hiện tượng gì là NaNO3
3. Luyện tập
3.1. Bài tập tự luận
Câu 1: Có 4 lọ không nhãn, mỗi lọ đựng một trong những dung dịch sau: NaOH, Na2SO4, H2SO4, HCl. Hãy nhận biết dung dịch trong mỗi lọ bằng phương pháp hoá học. Viết các phương trình hoá học.
Câu 2: 3,04 gam hỗn hợp NaOH và KOH tác dụng vừa đủ với dung dịch HCl, thu được 4,15 gam các muối clorua.
a) Viết các phương trình hoá học.
b) Tính khối lượng của mỗi hiđroxit trong hỗn hợp ban đầu.
Câu 3: Sục 3,36 lít khí CO2 (đktc) vào 300ml dd Ca(OH)2 0,2M và NaOH 0,3 M thu được m (g) kết tủa và dd Y. Cô cạn dd Y thu được m’( g) chất rắn khan. Tìm m và m’
Câu 4: Cho V lít CO2 ( đktc) tác dụng 500ml dung dịch Ca(OH)2 0,5M tạo thành 10 gam kết tủa . Tính giá trị của V?
3.2. Bài tập trắc nghiệm
Câu 1: Thuốc thử để nhận biết dung dịch Ca(OH)2 là:
A. Na2CO3
B. KCl
C. NaOH
D. NaNO3
Câu 2: Nhóm các dung dịch có pH > 7 là:
A. HCl, NaOH
B. H2SO4, HNO3
C. NaOH, Ca(OH)2
D. BaCl2, NaNO3
Câu 3: Để phân biệt hai dung dịch NaOH và Ba(OH)2 đựng trong hai lọ mất nhãn ta dùng thuốc thử:
A. Quỳ tím
B. HCl
C. NaCl
D. H2SO4
Câu 4: NaOH có tính chất vật lý nào sau đây?
A. Natri hiđroxit là chất rắn không màu, ít tan trong nước.
B. Natri hiđroxit là chất rắn không màu, hút ẩm mạnh, tan nhiều trong nước và tỏa nhiệt.
C. Natri hiđroxit là chất rắn không màu, hút ẩm mạnh và không tỏa nhiệt.
D. Natri hiđroxit là chất rắn không màu, không tan trong nước, không tỏa nhiệt.
Câu 5: Dãy các bazơ bị phân hủy ở nhiệt độ cao:
A. Ca(OH)2, NaOH, Zn(OH)2, Fe(OH)3
B. Cu(OH)2, NaOH, Ca(OH)2, Mg(OH)2
C. Cu(OH)2, Mg(OH)2, Fe(OH)3, Zn(OH)2
D. Zn(OH)2, Ca(OH)2, KOH, NaOH
Câu 6: Cặp chất đều làm đục nước vôi trong Ca(OH)2:
A. CO2, Na2O
B. CO2, SO2
C. SO2, K2O
D. SO2, BaO
4. Kết luận
Sau bài học cần nắm:
- Natri hiđroxit NaOH và Canxi hiđroxit Ca(OH)2 có những tính chất vật lí, tính chất hóa học nào?
- Những ứng dụng trong đời sống và sản xuất gồm những gì?
Tham khảo thêm
- docx Hoá học 9 Bài 1: Tính chất hóa học của oxit và Khái quát về sự phân loại oxit
- docx Hóa học 9 Bài 2: Một số oxit quan trọng
- docx Hóa học 9 Bài 3: Tính chất hóa học của axit
- docx Hóa học 9 Bài 4: Một số axit quan trọng
- docx Hóa học 9 Bài 5: Luyện tập tính chất hóa học của oxit và axit
- docx Hóa học 9 Bài 6: Thực hành: Tính chất hóa học của oxit và axit
- docx Hóa học 9 Bài 7: Tính chất hóa học của bazơ
- docx Hóa học 9 Bài 9: Tính chất hóa học của muối
- doc Hóa học 9 Bài 10: Một số muối quan trọng
- docx Hóa học 9 Bài 11: Phân bón hóa học
- docx Hóa học 9 Bài 12: Mối quan hẹ giữa các loại hợp chất vô cơ
- docx Hóa học 9 Bài 13: Luyện tập chương 1 Các loại hợp chất vô cơ
- docx Hóa học 9 Bài 14: Thực hành: Tính chất hóa học của bazơ và muối



