Giải bài tập SBT Hóa 12 Bài 22: Luyện tập Tính chất của kim loại
Hướng dẫn Giải bài tập Sách bài tập Hóa học 12 Bài 22 dưới đây sẽ giúp các em học sinh nắm vững phương pháp giải bài tập và ôn luyện tốt kiến thức về tính chất của kim loại . Mời các em cùng theo dõi.
Mục lục nội dung
1. Giải bài 22.1 trang 49 SBT Hóa học 12
2. Giải bài 22.2 trang 49 SBT Hóa học 12
3. Giải bài 22.3 trang 49 SBT Hóa học 12
4. Giải bài 22.4 trang 50 SBT Hóa học 12
5. Giải bài 22.5 trang 50 SBT Hóa học 12
6. Giải bài 22.6 trang 50 SBT Hóa học 12
7. Giải bài 22.7 trang 50 SBT Hóa học 12
8. Giải bài 22.8 trang 50 SBT Hóa học 12
9. Giải bài 22.9 trang 50 SBT Hóa học 12
10. Giải bài 22.10 trang 50 SBT Hóa học 12
11. Giải bài 22.11 trang 51 SBT Hóa học 12
12. Giải bài 22.12 trang 51 SBT Hóa học 12
13. Giải bài 22.13 trang 51 SBT Hóa học 12
14. Giải bài 22.14 trang 51 SBT Hóa học 12
15. Giải bài 22.15 trang 51 SBT Hóa học 12
16. Giải bài 22.16 trang 51 SBT Hóa học 12
17. Giải bài 22.17 trang 52 SBT Hóa học 12

1. Giải bài 22.1 trang 49 SBT Hóa học 12
Kim loại Ni phản ứng được với tất cả muối trong dung dịch ở dãy nào sau đây ?
A. NaCl, AlCl3, ZnCl2.
B. MgSO4, CuSO4, AgNO3
C. Pb(NO3)2, AgNO3, NaCl
D. AgNO3, CuSO4, Pb(NO3)2.
Phương pháp giải
Dựa vào điều kiện về tính chất hóa học của Ni khi tác dụng với muối để chọn đáp án đúng.
Hướng dẫn giải
Kim loại mạnh đẩy kim loại yếu ra khỏi dd muối

=> Tính khử kim loại Ni>Pb>Cu>Ag
=> Chọn D.
2. Giải bài 22.2 trang 49 SBT Hóa học 12
Cho ba kim loại là Al, Fe, Cu và bốn dung dịch muối riêng biệt là ZnSO4, AgNO3, CuCl2, MgSO4. Kim loại nào tác dụng được với cả bốn dung dịch muối đã cho ?
A. Al.
B. Fe
C. Cu
D. Không kim loại nào tác dụng được.
Phương pháp giải
Cần nắm rõ quy tắc kim loại mạnh đẩy kim loại yếu ra khỏi dung dịch muối và dãy điện hóa kim loại để xác định kim loại có thể tác dụng được với cả bốn dung dịch muối đã cho.
Hướng dẫn giải
Kim loại mạnh đẩy kim loại yếu ra khỏi dung dịch muối

=> Tính khử kim loại Mg>Al>Zn>Fe>Cu>Ag
=> Chọn D.
3. Giải bài 22.3 trang 49 SBT Hóa học 12
Cho Cu dư tác dụng với dung dịch AgNO3 thu được dung dịch X. Cho Fe dư tác dụng với dung dịch X được dung dịch Y. Dung dịch Y chứa
A. Fe(NO3)2.
B. Fe(NO3)3.
C. Fe(NO3)2, Cu(NO3)2 dư.
D. Fe(NO3)3, Cu(NO3)2 dư.
Phương pháp giải
Viết phương trình hóa học xảy ra của phản ứng trên.
=> Xác định dung dịch Y
Hướng dẫn giải
+ AgNO3 → Cu(NO3)2 + Ag
=> Dung dịch X là Cu(NO3)2
+ Cu(NO3)2 → Fe(NO3)2 + Cu
=> Dung dịch X là Fe(NO3)2
=> Chọn A
4. Giải bài 22.4 trang 50 SBT Hóa học 12
Cho 2,52 g một kim loại tác dụng với dung dịch H2SO4 loãng tạo ra 6,84 g muối sunfat. Kim loại đó là
A. Mg. B. Fe.
C. Al. D. Zn.
Phương pháp giải
- Viết phương trình hóa học
- Tính toán số mol của kim loại theo phương trình
Suy ra kim loại cần tìm.
Hướng dẫn giải
Gọi kim loại là M
\({n_M} = \frac{{2.52}}{M}\)
\({n_{muối}} = \frac{{6,84}}{{2M + 96x}}\)
\(2M + x{H_2}S{O_4} \to {M_2}{(S{O_4})_2} + x{H_2}\)
\({n_M} = 2{n_{muối}}\)
\( \to \frac{{2.52}}{M} = \frac{{2.6,84}}{{2M + 96x}}\)
=>M = 28.x
Vì M là kim loại nên x có giá trị 1,2,3
=> Chọn x = 2, M = 56 hợp lí
=> Chọn B.
5. Giải bài 22.5 trang 50 SBT Hóa học 12
Cho 2,06 g hỗn hợp gồm Fe, Al và Cu tác dụng với dung dịch HNO3 loãng, dư thu được 0,896 lít NO duy nhất (đktc). Khối lượng muối nitrat sinh ra là
A. 9,5 g. B. 7,44 g.
C. 7,02 g. D. 4,54 g.
Phương pháp giải
- Khối lượng muối= Khối lượng kim loại + khối lượng gốc nitrat trong muối
3)−=nenhận=3nNO
Hướng dẫn giải
nNO = 0,04 mol
nNO3- = ne nhận = 3nNO = 0,12 mol
mmuối = 2,06 + 0,12.62 = 9,5 (gam)
Chọn A.
6. Giải bài 22.6 trang 50 SBT Hóa học 12
Cho hỗn hợp Fe và Zn tác dụng với dung dịch hỗn hợp chứa 0,01 mol HCl và 0,05 mol H2SO4. Sau phản ứng thu được chất rắn X, dung dịch Y và khí Z. Cho khí Z đi qua CuO dư, đun nóng thu được m gam Cu. Giá trị của m là
A. 5,32. B. 3,52.
C. 2,35. D. 2,53.
Phương pháp giải
- Sau phản ứng thu được chất rắn => axit phản ứng hết
- Bảo toàn nguyên tố "H" => số mol hiđro=> số mol Cu
Hướng dẫn giải
Sau phản ứng thu được chất rắn => axit phản ứng hết
Bảo toàn nguyên tố H:
nH+ = nHCl + nH2SO4 = 0,01 + 2.0,05 = 0,11 mol = 2nH2
nH2 = 0,055 mol
CuO + H2 → Cu + H2O
0,055 0,055
mCu = 3,52 gam.
Chọn B.
7. Giải bài 22.7 trang 50 SBT Hóa học 12
Cho 6 g hợp kim Cu, Fe và Al vào dung dịch axit HCl dư thấy thoát ra 3,024 lít H2 (đktc) và 1,86 g chất rắn không tan. Thành phần phần trăm của hợp kim là
A. 40% Fe, 28% Al, 32% Cu.
B. 41% Fe, 29% Al, 30% Cu.
C. 42% Fe, 27% Al, 31% Cu.
D. 43% Fe, 26% Al, 31% Cu.
Phương pháp giải
Chất rắn không tan là Cu
- Viết phương trình hóa học Fe và Al tác dụng HCl
- Lập hệ phương trình tính số mol Fe và Al
- Tính khối lượng và % từng chất
Hướng dẫn giải
Chất rắn không tan là Cu => Zn= 6−1,86 = 4,14g
Gọi số mol Fe, Al là x, y
Fe + 2HCl → FeCl2 + H2
x x
2Al + 6HCl → 2AlCl3 + 3H2
y 3/2y
Ta có hệ x + 3/2y=0,135(1); 56x +27y=4,14 (2)
=> x = 0,045; y = 0,06
mFe = 2,52 gam; mAl = 1,62 gam.
%Fe = 2,52/6.100% = 42%
%Al = 1,62/6.100% = 27%
%Cu = 31%
Chọn C.
8. Giải bài 22.8 trang 50 SBT Hóa học 12
Nhúng một lá Mg vào dung dịch chứa 2 muối FeCl3 và FeCl2. Sau một thời gian lấy lá Mg ra làm khô rồi cân lại thấy khối lượng giảm so với ban đầu. Dung dịch sau thí nghiệm có cation nào sau đây ?
A. Mg2+.
B. Mg2+ và Fe2+.
C. Mg2+, Fe2+ và Fe3+
D. Mg2+ hoặc Mg2+, Fe2+ và Fe3+.
Phương pháp giải
Dựa vào hiện tượng của phản ứng trên để xác định phản ứng xảy ra trước. Từ đó xác định các cation trong dung dịch sau thí nghiệm.
Hướng dẫn giải
Mg phản ứng với 3+ tạo 2+ => khối lượng thanh Mg giảm
=> Chọn C.
9. Giải bài 22.9 trang 50 SBT Hóa học 12
Cho Fe tác dụng với dung dịch NO3 dư thu được dung dịch X. Cho Cu dư vào dung dịch X thu được dung dịch Y. Dung dịch Y chứa
A. Fe(NO3)2
B. Fe(NO3)3
C. Fe(NO3)2 và Cu(NO3)2
D. Fe(NO3)3 và AgNO3
Phương pháp giải
Viết phương trình hóa học ở mỗi phản ứng để xác định các chất có trong dung dịch Y.
Hướng dẫn giải
Fe + AgNO3 dư → Fe(NO3)2 + Ag
Fe(NO3)2 + AgNO3 → Fe(NO3)3 + Ag
Dung dịch X: AgNO3 và Fe(NO3)3
Cu + AgNO3 → Cu(NO3)2 + Ag
Cu + Fe(NO3)3 → Cu(NO3)2 + Fe(NO3)2
Dung dịch Y: Cu(NO3)2 và Fe(NO3)2
Chọn C.
10. Giải bài 22.10 trang 50 SBT Hóa học 12
Hỗn hợp X gồm 3 kim loại : Fe, Ag, Cu. Cho X vào dung dịch Y chỉ chứa 1 chất tan, khuấy kĩ cho đến khi phản ứng kết thúc thấy Fe và Cu tan hết và còn lại Ag không tan đúng bằng lượng Ag vốn có trong hỗn hợp X. Chất tan trong dung dịch Y là
A. AgNO3 B. Cu(NO3)2.
C. Fe2(SO4)3. D. FeSO4.
Phương pháp giải
Dựa vào hiện tượng của mô tả của quá trình phản ứng trên để xác định chất tan có trong dung dịch Y.
Hướng dẫn giải
Ta thấy Fe và Cu tan hết và còn lại Ag không tan đúng bằng lượng Ag vốn có trong hỗn hợp X
=> Fe2(SO4)3 hòa tan được Cu, Fe
=> Chọn C.
11. Giải bài 22.11 trang 51 SBT Hóa học 12
Cho hỗn hợp Al, Fe vào dung dịch chứa AgNO3 và Cu(NO3)2 được dung dịch X và chất rắn Y gồm 3 kim loại. Chất rắn Y gồm
A. Al, Fe, Cu. B. Fe, Cu,Ag.
C. Al, Cu, Ag. D. Al, Fe,Ag.
Phương pháp giải
Cần nắm rõ thứ tự các kim loại phản ứng trong với các dung dịch AgNO3 và Cu(NO3)2 để xác định 3 kim loại trong Y.
Hướng dẫn giải
Al, Fe phản ứng với hai muối thu hai kim loại Cu , Ag
Al phản ứng với hai muối trước. Thu được ba kim loại => Fe dư
Sau phản ứng ba kim loại là Fe, Cu, Ag
=> Chọn B .
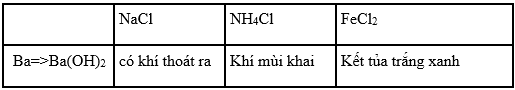
12. Giải bài 22.12 trang 51 SBT Hóa học 12
Cho các dung dịch sau đựng trong các lọ riêng biệt Cl, NH4Cl, FeCl2, FeCl3,
H4)2SO4. Kim loại nào sau đây có thể phân biệt được dung dịch trên
A. Al B. Mg
C. Ba D. Na
Phương pháp giải
Dựa vào tính chất hóa học đặc trưng của Cl, NH4Cl, FeCl2, FeCl3, H4)2SO4 để chọn kim loại có thể phân biệt được dung dịch trên cho phù hợp.
Hướng dẫn giải
Ta có Ba phản ứng với nước cho dung dịch bari hiđroxit các ống nghiệm đều thoát khí
Chọn C.
13. Giải bài 22.13 trang 51 SBT Hóa học 12
Hãy trình bày phương pháp hoá học để điều chế từng kim loại từ hỗn hợp muối sau :
a) AgNO3 và Pb(NO3)2.
b) AgNO3 và Cu(NO3)2.
c) AgNO3, Cu(NO3)2 và Pb(NO3)2.
Phương pháp giải
Áp dụng tính chất kim loại mạnh dẩy kim loại yếu ra khỏi dung dịch muối, từ đó trình bày phương pháp hoá học để điều chế từng kim loại từ hỗn hợp muối đã cho ở mỗi trường hợp.
Hướng dẫn giải
a) Ngâm lá Pb (dư) trong dung dịch hỗn hợp được Ag. Từ dung dịch Pb(NO3)2 có thể dùng phương pháp điện phân hoặc dùng kim loại mạnh hơn Pb để đẩy Pb ra khỏi dung dịch muối.
b) Ngâm lá Cu (dư) trong dung dịch hỗn hợp, được Ag và dung dịch Cu(NO3)2. Dùng phương pháp điện phân hoặc kim loại mạnh để đẩy Cu.
c) Trước hết, ngâm lá Cu (dư) trong dung dịch được Ag và dung dịch hỗn hợp hai muối là Cu(NO3)2 và Pb(NO3)2. Sau đó ngâm lá Pb (dư) trong dung dịch hỗn hợp, được Cu và dung dịch Pb(NO3)2. Từ dung dịch Pb(NO3)2 có thể điều chế Pb bằng phương pháp điện phân hoặc dùng kim loại mạnh để đẩy Pb.
14. Giải bài 22.14 trang 51 SBT Hóa học 12
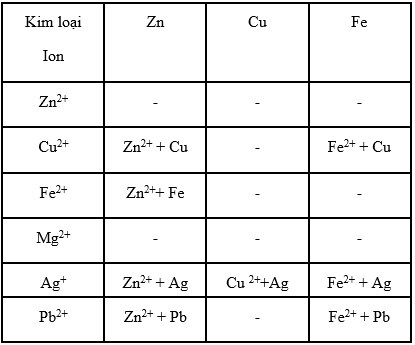
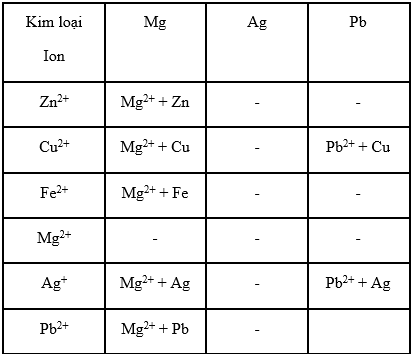
Có sáu dung dịch, mỗi dung dịch chỉ có một loại cation : Zn2+, Cu2+, Mg2+, Fe2+, Ag+, Pb2+ và sáu kim loại là : Zn, Cu, Mg, Fe, Ag, Pb.
a) Hãy lập bảng để trình bày những kim loại nào có thể phản ứng với những dung dịch chứa cation nào ?
b) Từ những kết quả trong bảng có thể rút ra kết luận gì về tính oxi hoá của ion Ag+ và Mg2+, tính khử của kim loại Ag và Mg ?
c) Sắp xếp những cặp oxi hoá- khử của những chất nói trên theo một thứ tự nhất định về tính chất hoá học.
Phương pháp giải
a) Cần nắm rõ tính chất hóa học của xác định những kim loại nào có thể phản ứng với những dung dịch chứa cation nào đã cho.
b) Dựa vào kết quả trong bảng để kết luận về tính oxi hoá của ion Ag+ và Mg2+, tính khử của kim loại Ag và Mg.
c) Dựa vào dãy điện hóa của kim loại để sắp xếp những cặp oxi hoá- khử của những chất nói trên.
Hướng dẫn giải
a)
b) Tính oxi hoá và tính khử :
- Cation Ag+ oxi hoá được tất cả các kim loại đã cho, Ag+ là chất oxi hoá mạnh nhất.
- Kim loại Mg khử được tất cả các kim loại đã cho, Mg là chất khử mạnh nhất.
- Cation Mg2+ không oxi hoá được những kim loại đã cho, Mg2+ là chất oxi hoá yếu nhất.
- Kim loại Ag không khử được kim loại nào đã cho, Ag là chất khử yếu nhất.
c) Sắp xếp cặp oxi hoá - khử :
Mg2+/Mg ; Zn2+/Zn ; Fe2+/Fe ; Pb2+/Pb ; Cu2+/Cu ; Ag+/Ag.
Từ trái sang phải :
- Tính oxi hoá của các cation kim loại tăng dần.
- Tính khử của các kim loại giảm dần.
15. Giải bài 22.15 trang 51 SBT Hóa học 12
Người ta phủ một lớp bạc lên một vật bằng đồng có khối lượng 8,84 g bằng cách ngâm vật đó trong dung dịch AgNO3. Sau một thời gian lấy vật ra khỏi dung dịch, rửa nhẹ, làm khô, khối lượng của vật là 10,36 g.
a) Cho biết các cặp oxi hoá - khử của kim loại trong phản ứng. Vai trò của các chất tham gia phản ứng. Viết phương trình hoá học dạng ion thu gọn.
b)Tính khối lượng bạc phủ trên bề mặt vật bằng đồng. Giả thiết toàn bộ bạc thoát ra đều bám vào vật bằng đồng.
Phương pháp giải
- Chất oxi hóa là chất nhận e , chất khử là chất cho e
- Viết PTHH, áp dụng tăng giảm khối lượng => khối lượng bạc phủ lên bề mặt đồng.
Hướng dẫn giải
a) Các cặp oxi hoá - khử của các kim loại có trong phản ứng
Cu2+/Cu và Ag+/Ag
Vai trò của các chất tham gia phản ứng : Ag+ là chất oxi hoá ; Cu là chất khử.
Cu + 2Ag+ →Cu2+ + 2Ag
b) Cu + 2AgNO3 → Cu(NO3)2 + 2Ag ( 1 )
64 g → 2.108
=> tăng 216 - 64 = 152 (g)
Theo (1), khối lượng vật bằng đồng tăng 152 g thì có 216 g bạc phủ lên trên. Theo bài ra, khối lượng vật tăng là : 10,36 - 8,84 = 1,52 (g)
Vậy khối lượng bạc phủ lên trên vật bằng đồng là 2,16 g.
16. Giải bài 22.16 trang 51 SBT Hóa học 12
Pha chế dung dịch CuSO4 bằng cách hoà tan 87 g CuSO4.5H2O trong nước, thu được 750 ml dung dịch.
a) Tính nồng độ mol của dung dịch CuSO4 đã pha chế.
b) Có bao nhiêu ion Cu2+ và SO42- trong 1 ml dung dịch ?
c) Thêm một lượng mạt sắt dư vào 50 ml dung dịch CuSO4 trên. Hãy cho biết khối lượng các kim loại tham gia và tạo thành sau phản ứng.
Phương pháp giải
- Tính nồng độ mol muối = nồng độ mol của các ion
- Số ion trong 1 mol là 6,02.1023
- Tính số mol muối trong 50 ml dung dịch => Khối lượng kim loại tham gia phản ứng và kim loại tạo thành.
Hướng dẫn giải
a) CM = 0,464M
b) Trong 1 ml dung dịch CuSO4 có :
nCu2+ = n(SO4)2- = nCuSO4 = 0,464.10-3 (mol)
Số ion Cu2+ = số ion SO42-
= 0,464.10-3.6,02.1023 = 2,793.1020 (ion)
c) Fe + Cu2+ → Fe2+ + Cu
nCu 2+ = 0,0232 mol ; mFe = 1,2992 g ; mCu = 1,4848 g.
17. Giải bài 22.17 trang 52 SBT Hóa học 12
Chia 100 g dung dịch muối có nồng độ 6,8% làm hai phần bằng nhau.
- Phần một cho tác dụng với dung dịch NaOH dư, tạo ra một bazơ không tan, làm khô chất này thu được một oxit có khối lượng 2,32 g.
- Phần hai cho tác dụng với dung dịch NaCl dư thu được 2,87 g kết tủa không tan trong dung dịch axit.
a) Xác định công thức hoá học của muối có trong dung dịch ban đầu.
b) Trình bày các phương pháp hoá học điểu chế kim loại từ muối tìm được ở trên.
Phương pháp giải
Đặt công thức của muối là AmBn. Khối lượng mol của A, B là X, Y.
- Phần 1 ta có 2(mX + nY) g AmBn tạo thành m(2X + 16n) g A2On.
=>3,4m(2X + 16n) = 2,32.2(mX + nY)
- Phần 2 (mX + nY) g AmBn tạo thành m(X + 35,5n) g ACln.
=>3,4m(X + 35,5n) = 2,87(mX + nY)
=> Tìm X và n => gốc axit
Hướng dẫn giải
a) Đặt công thức của muối là AmBn. Khối lượng mol của A, B là X, Y.
Khối lượng muối trong mỗi phần là 3,4 g. Ta có sơ đồ biến đổi các chất trong thí nghiệm 1 :
\(2{A_m}{B_n}\xrightarrow{{NaOH}}2mA{(OH)_n}\xrightarrow{{{t^o}}}m{A_2}{O_n}\)
Theo sơ đồ : 2(mX + nY) g AmBn tạo thành m(2X + 16n) g A2On.
Theo bài toán : 3,4 g AmBn →2,32 g A2On
Ta có phương trình : 3,4m(2X + 16n) = 2,32.2(mX + nY) (1)
Sơ đồ biến đổi các chất trong thí nghiệm 2 :
\({A_m}{B_n}\xrightarrow{{NaCl}}mAC{l_n}\)
Theo sơ đồ : (mX + nY) g AmBn tạo thành m(X + 35,5n) g ACln.
Theo bài toán : 3,4 g AmBn →2,87 g ACln
Ta có phương trình : 3,4m(X + 35,5n) = 2,87(mX + nY) (2)
Chia ( 1 ) cho (2) ta được (X+35,5n) = 4,46/2,87→X=108n
Giá trị có thể chấp nhận là n = 1 và X = 108. Vậy kim loại A là Ag.
Thay n = 1 và X = 108 vào (1) hoặc (2) ta có Y = 62m. Gốc axit trong muối bạc không thể là gốc halogenua hoặc sunfua mà là gốc axit có oxi có khối lượng 62, gốc đó là NO3-
Vậy công thức hoá học của muối là AgNO3.
b) Điều chế Ag từ AgNO3 :
Dùng kim loại mạnh hơn Ag để đẩy Ag : Cu + 2AgNO3 →Cu(NO3)2 + 2Ag
Nhiệt phân :
\(AgN{O_3}\xrightarrow{{{t^o}}}Ag + N{O_2} + {O_2}\)
Điện phân với điện cực trơ :
NO3 + 2H2O → 4Ag + O2 HNO3
18. Giải bài 22.18 trang 52 SBT Hóa học 12
Ngâm một lá kim loại có khối lượng 50 gam trong dung dịch HCl, sau khi thu được 336 ml H2 (đktc) thì khối lượng lá kim loại giảm 1,68%. Xác định kim loại đã dùng.
Phương pháp giải
- Khối kim loại giảm là khối lượng kim loại phản ứng
- Gọi kim loại cần tìm là M có hóa trị x
- Số mol kim loại theo số mol hiđro => phương trình giữa M và x=> Lập bảng tìm M và x.
Hướng dẫn giải
Khối lượng kim loại giảm bằng khối lượng kim loại đã phản ứng bằng : 50.0,0168 = 0,84 (gam)
Đặt kim loại là M (hoá trị n), ta có PTHH :
2M + 2nH+ → 2Mn+ + nH2
← 0,015 (mol)
= (0,84/0,03)n=28n
Biện luận: Suy ra n = 2, M là 56 (Fe)
19. Giải bài 22.19 trang 52 SBT Hóa học 12
Trong một bình kín dung tích không đổi 16,8 lít chứa khí Cl2 (đktc) và một ít bột kim loại M. Sau khi phản ứng hoàn toàn giữa Cl2 và M, áp suất khí trong bình còn lại 0,8 atm, lượng muối tạo thành là 16,25 gam. Nhiệt độ bình không đổi 0°C, thể tích kim loại M và muối rắn của nó không đáng kể. Xác định kim loại M.
Phương pháp giải
- Tính số mol 2 phản ứng
- Tính Số mol muối => Khối lượng mol của muối
- Suy ra kim loại cần tìm.
Hướng dẫn giải
Số mol Cl2 ban đầu là 0,75 mol ;
Số mol Cl2 sau phản ứng là : 0,082.273)=0,6mol
⟹ Số mol Cl2 đã phản ứng là 0,15 mol
2M + nCl2 → 2MCln
0,15 0,3/n
MMCln = (16,25/0,3).n = 54,167n = M + 35,5n
→ M = 18,67n
⟹ n = 3 ; M = 56 (Fe).
Tham khảo thêm
- doc Giải bài tập SBT Hóa 12 Bài 17: Vị trí của kim loại trong bảng tuần hoàn và cấu tạo của kim loại
- doc Giải bài tập SBT Hóa 12 Bài 18: Tính chất của kim loại. Dãy điện hóa của kim loại
- doc Giải bài tập SBT Hóa 12 Bài 19: Hợp kim
- doc Giải bài tập SBT Hóa 12 Bài 20: Sự ăn mòn kim loại
- doc Giải bài tập SBT Hóa 12 Bài 21: Điều chế kim loại
- doc Giải bài tập SBT Hóa 12 Bài 23: Luyện tập Điều chế kim loại và sự ăn mòn kim loại