Giải bài tập SBT Hóa 12 Bài 17: Vị trí của kim loại trong bảng tuần hoàn và cấu tạo của kim loại
Hướng dẫn Giải bài tập Sách bài tập Hóa học 12 Bài 17 dưới đây sẽ giúp các em học sinh nắm vững phương pháp giải bài tập và ôn luyện tốt kiến thức về vị trí của kim loại trong bảng tuần hoàn và cấu tạo của kim loại. Mời các em cùng theo dõi.
Mục lục nội dung
1. Giải bài 17.1 trang 35 SBT Hóa học 12
2. Giải bài 17.2 trang 35 SBT Hóa học 12
3. Giải bài 17.3 trang 35 SBT Hóa học 12
4. Giải bài 17.4 trang 35 SBT Hóa học 12
5. Giải bài 17.5 trang 36 SBT Hóa học 12
6. Giải bài 17.6 trang 36 SBT Hóa học 12
7. Giải bài 17.7 trang 36 SBT Hóa học 12
8. Giải bài 17.8 trang 36 SBT Hóa học 12
9. Giải bài 17.9 trang 36 SBT Hóa học 12
10. Giải bài 17.10 trang 36 SBT Hóa học 12
11. Giải bài 17.11 trang 36 SBT Hóa học 12
12. Giải bài 17.12 trang 37 SBT Hóa học 12

1. Giải bài 17.1 trang 35 SBT Hóa học 12
Liên kết kim loại là liên kết được hình thành do
A. Các đôi electron dùng chung giữa 2 nguyên tử.
B. Sự nhường cặp electron chưa tham gia liên kết của nguyên tử này cho nguyên tử kia để tạo thành liên kết giữa hai nguyên tử.
C. Lực hút tĩnh điện giữa ion dương và ion âm.
D. Sự tham gia của các electron tự do giữa các nguyên tử và ion kim loại trong mạng tinh thể.
Phương pháp giải
Cần nắm rõ khái niệm liên kết kim loại để chọn đáp án phù hợp.
Hướng dẫn giải
Liên kết kim loại: là liên kết được hình thành giữa các nguyên tử và ion kim loại trong mạng tinh thể do sự tham gia của electron tự do.
=> Chọn D.
2. Giải bài 17.2 trang 35 SBT Hóa học 12
Những nhóm nguyên tố nào dưới đây ngoài nguyên tố kim loại còn có nguyên tố phi kim?
A. Tất cả các nguyên tố f.
B. Tất cả các nguyên tố d.
C. Tất cả các nguyên tố s ( trừ nguyên tố H).
D. Tất cả các nguyên tố p.
Phương pháp giải
Cần nắm rõ đặc điểm của các nguyên tố s, p, d, f để xác định nguyên tố nào ngoài nguyên tố kim loại còn có nguyên tố phi kim.
Hướng dẫn giải
Nguyên tố p có thể là kim loại hoặc phi kim
=> Chọn D.
3. Giải bài 17.3 trang 35 SBT Hóa học 12
Tính chất hóa học đặc trưng của kim loại là tính khử (dễ bị oxi hóa thành ion dương) vì:
A. Nguyên tử kim loại thường có 5, 6, 7 electron lớp ngoài cùng.
B. Nguyên tử kim loại có năng lượng ion hóa nhỏ.
C. Kim loại có xu hướng thu thêm electron để đạt cấu hình của khí hiếm.
D. Nguyên tử kim loại có độ âm điện lớn.
Phương pháp giải
Dựa vào lí thuyết bài sự biến đổi tuần hoàn tính chất của các nguyên tố hóa học, định luật tuần hoàn và cấu hình e nguyên tử.
Hướng dẫn giải
Nguyên tử phi kim thường có 5, 6, 7 electron lớp ngoài cùng
Phi kim có xu hướng thu thêm electron để đạt cấu hình của khí hiếm
Nguyên tử phi kim có độ âm điện lớn.
=> Chọn B.
4. Giải bài 17.4 trang 35 SBT Hóa học 12
Cho các kim loại: Na, Ca, Fe, Zn, Cu, Ag. Những kim loại không khử được nước , dù ở nhiệt độ cao là:
A. Fe, Zn, Cu, Ag.
B. Cu, Ag.
C. Na, Ca, Cu, Ag.
D. Fe, Cu, Ag.
Phương pháp giải
Dựa vào lí thuyết bài tính chất của kim loại, dãy điện hóa của kim loại để xác định kim loại không khử được nước, dù ở nhiệt độ cao trong các kim loại đã cho.
Hướng dẫn giải
Cu, Ag không khử được nước, dù ở nhiệt độ cao.
=> Chọn B.
5. Giải bài 17.5 trang 36 SBT Hóa học 12
Cho a mol Mg và b mol Zn vào dung dịch chứa c mol 2+ và d mol Ag+. Biết rằng a< ( c+ d/2). Để thu được một dung dịch chứ 3 ion kim loại thì mối quan hệ giữa b và a, c, d là
A. b > c - a
B. b < c - a
C. b > c - a + d/2
D. b < c - a + d/2
Phương pháp giải
- Dung dịch chứa ba ion kim loại => 2+ dư
- Viết phương trình hóa học
- Tính theo phương trình hóa học
Hướng dẫn giải
Dung dịch chứa ba ion kim loại => + phản ứng hết
Mg + 2Ag+ → Mg2+ + 2Ag
Zn + 2Ag+ → Zn2+ + 2Ag
nMg, Zn dư= nAg+/2 = d/2
nMg, Zn còn lại= a + b - d/2
Dung dịch chứa ba ion kim loại => 2+ dư
→ c > a + b - d/2
→ b < c - a + d/2
Chọn D.
6. Giải bài 17.6 trang 36 SBT Hóa học 12
M là kim loại trong số các kim loại sau: Cu Ba, Zn, Mg. Dung dịch muối l2 phản ứng với dung dịch 2CO3 hoặc 2SO4 tạo kết tủa, nhưng không tạo kết tủa khi phản ứng với dung dịch NaOH. Kim loại M là
A. Mg B. Cu
C. Ba D. Zn
Phương pháp giải
Dung dịch muối l2 không tạo kết tủa khi phản ứng với dung dịch NaOH => Ba thỏa mãn.
Hướng dẫn giải
Dung dịch muối l2 phản ứng với dung dịch 2CO3 hoặc 2SO4 tạo kết tủa, nhưng không tạo kết tủa khi phản ứng với dung dịch NaOH => Kim loại là Ba
BaCl2 + Na2CO3 → BaCO3 + 2NaCl
BaCl2 + Na2SO4 → BaSO4 + 2NaCl
BaCl2 + NaOH phản ứng không xảy ra.
Chọn C.
7. Giải bài 17.7 trang 36 SBT Hóa học 12
Tổng số hạt proton, nơtron, electron trong nguyên tử của một nguyên tố là 155.Số hạt mang điện nhiều hơn số hạt không mang điện là 33. Nguyên tố đó là
A. bạc. B. đồng,
C. chì. D. sắt.
Phương pháp giải
- P + E + N = 155 (lưu ý P=E)
- P + E - N = 33
=> Tìm P => số hiệu nguyên tử = P => tên kim loại
Hướng dẫn giải
\(\left\{ \begin{gathered}
2p + n = 155 \hfill \\
2p - n = 33 \hfill \\
\end{gathered} \right.\)
\( \to \left\{ \begin{gathered}
n = 61 \hfill \\
p = 47 \hfill \\
\end{gathered} \right.\)
=> Z = 47=> kim loại Ag
=> Chọn A.
8. Giải bài 17.8 trang 36 SBT Hóa học 12
Một nguyên tử có tổng số hạt proton, nơtron, electron là 40. Đó là nguyên tử của nguyên tố nào sau đây ?
Ạ. Canxi B. Bari
C. Nhôm D. Sắt
Phương pháp giải
N + P + E = 40 ( P=E)=> N= 40-2P
P ≤ N ≤ 1,5P
=> Giải bất phương trình tìm P
Suy ra tên nguyên tố cần tìm.
Hướng dẫn giải
N + P + E = 40; N + 2P = 40
N = 40 – 2P; P ≤ N ≤ 1,5P
11,43 ≤ P ≤13,33
Có hai trường hợp : P = 12 ⟹ N = 16 (loại)
P= 13 ⟹ N = 14 ⟹ Al.
=> Chọn C.
9. Giải bài 17.9 trang 36 SBT Hóa học 12
Những tính chất vật lí chung của kim loại (tính dẻo, dẫn điện, dẫn nhiệt, ánh kim) gây ra do:
A. Khối lượng nguyên tử kim loại.
B. Cấu trúc mạng tinh thể.
C. Tính khử của kim loại.
D. Các electron tự do trong kim loại.
Phương pháp giải
Cần nắm rõ nguyên nhân của tính chất vật lí chung của kim loại (tính dẻo, dẫn điện, dẫn nhiệt, ánh kim).
Hướng dẫn giải
Những tính chất vật lí chung của kim loại ( tính dẻo, dẫn điện, dẫn nhiệt, ánh kim) gây ra do các electron tự do trong kim loại.
=> Chọn D.
10. Giải bài 17.10 trang 36 SBT Hóa học 12
Dãy sắp xếp nào dưới đây đúng theo thứ tự giảm dần bán kính nguyên tử và ion?
A. Ne > Na+ > Mg2+ B. Na+ > Ne > Mg2+
C. Na+ > Mg2+ > Ne D. Mg2+ > Na+ > Ne
Phương pháp giải
Dựa vào lí thuyết bài sự biến đổi tuần hoàn các nguyên tố hóa học, định luật tuần hoàn để sắp xếp các ion và nguyên tử theo thứ tự giảm dần bán kính nguyên tử và ion.
Hướng dẫn giải
, Na+, Mg2+ có cùng cấu hình e do điện tích hạt nhân tăng dần do đó lực hút giữa hạt nhân và e tăng lên => Bán kính giảm dần.
Chọn A.
11. Giải bài 17.11 trang 36 SBT Hóa học 12
Nguyên tử Na và Cl có các lớp electron là: (Na) 2/8/1; (Cl) 2/8/7. Trong phản ứng hóa học các nguyên tử Na và Cl đạt được cấu hình bền với 8e ở lớp ngoài cùng bằng cách:
A. Hai nguyên tử góp chung electron.
B. Nguyên tử Na nhường 1e cho nguyên tử Clo để lớp electron ngoài cùng của nguyên tử Na và Cl đều có 8e.
C. Nguyên tử Cl nhường 7e cho nguyên tử Na để cho lớp electron ngoài cùng của nguyên tử Cl và Na đều có 7e.
D. Tùy điều kiện của phản ứng mà nguyên tử Na nhường e hoặc nguyên tử Cl nhường e.
Phương pháp giải
Dựa vào lí thuyết bài cấu hình e nguyên tử và cách đạt đạt cấu hình e bền vững của khí hiếm để chọn đáp án đúng.
Hướng dẫn giải
Các nguyên tử trong phân tử có xu hướng đạt cấu hình e bền vững của khí hiếm
=> Nguyên tử Na nhường 1e cho nguyên tử Clo để lớp electron ngoài cùng của nguyên tử Na và Cl đều có 8e
=> Chọn B.
12. Giải bài 17.12 trang 37 SBT Hóa học 12
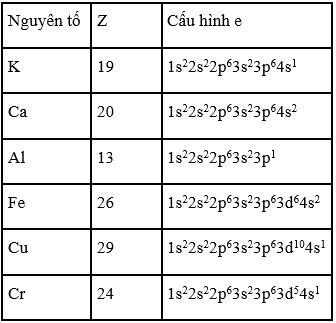
Viết cấu hình electron nguyên tử của các nguyên tố kim loại : K, Ca, Al, Fe, Cu, Cr. Có nhận xét gì về cấu hình electron nguyên tử của các nguyên tố.
Phương pháp giải
Dựa vào lí thuyết bài cấu hình e nguyên tử => Viết cấu hình e của nguyên tố trên => Nhận xét cấu hình electron nguyên tử.
Hướng dẫn giải
Trong nguyên tử Cr và Cu một electron trong lớp có năng lượng thấp 4s điền vào lớp có năng lượng cao hơn 3d, chúng có cấu hình lớp ngoài cùng là 3d5 4s1 và 3d10 4s1
13. Giải bài 17.13 trang 37 SBT Hóa học 12
Hãy so sánh số electron ở lớp ngoài cùng của nguyên tử kim loại nhóm IA, IIA và phi kim nhóm VIA, VIIA.
Phương pháp giải
Cần nắm rõ đặc điểm của số electron ở lớp ngoài cùng của nguyên tử kim loại nhóm IA, IIA và phi kim nhóm VIA, VIIA để so sánh.
Hướng dẫn giải
Số e ở lớp ngoài cùng của nguyên tử kim loại nhóm IA, IIA là 1,2 của phi kim nhóm VIA, VIIA là 6,7.
14. Giải bài 17.14 trang 37 SBT Hóa học 12
Dựa vào khối lượng riêng của kim loại, hãy tính thể tích mol kim loại và ghi kết quả vào bảng sau:
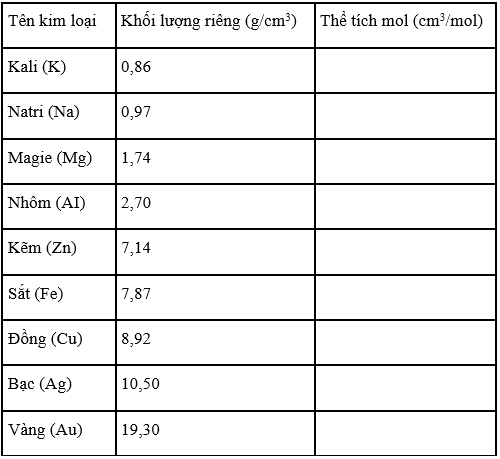
Phương pháp giải
- Áp dụng công thức m/V => = V/m = V/(M.n)
- Thể tích mol = V/mol
Hướng dẫn giải
Tham khảo thêm
- doc Giải bài tập SBT Hóa 12 Bài 18: Tính chất của kim loại. Dãy điện hóa của kim loại
- doc Giải bài tập SBT Hóa 12 Bài 19: Hợp kim
- doc Giải bài tập SBT Hóa 12 Bài 20: Sự ăn mòn kim loại
- doc Giải bài tập SBT Hóa 12 Bài 21: Điều chế kim loại
- doc Giải bài tập SBT Hóa 12 Bài 22: Luyện tập Tính chất của kim loại
- doc Giải bài tập SBT Hóa 12 Bài 23: Luyện tập Điều chế kim loại và sự ăn mòn kim loại