Hoá học 9 Bài 39: Benzen
Benzen là hiđrocacbon khác với metan, etilen, axetilen. Vậy benzen có cấu tạo và tính chất như thế nào, chúng ta hãy cùng nhau tìm hiểu qua bài giảng về Benzen.
Mục lục nội dung

1. Tóm tắt lý thuyết
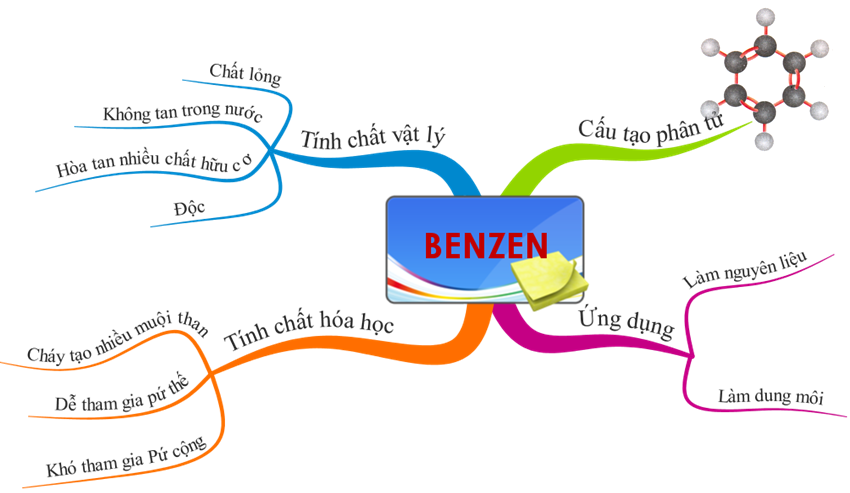
1.1. Tính chất vật lí
- Chất lỏng, không màu, không tan trong nước, nhẹ hơn nước, hoà tan nhiều chất nhiều chất như dầu ăn, nến cao su, iốt.
- Benzen độc.
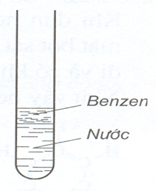
1.2. Cấu tạo phân tử
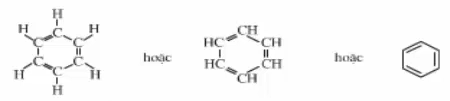
Trong CTCT của benzen có 3 liên kết đôi và 3 liên kết đơn xen kẽ nhau.
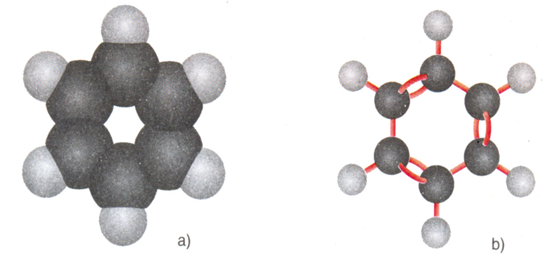
a) Dạng đặc b) Dạng rỗng
a. Benzen có cháy không?
Benzen dễ cháy tạo ra CO2 và nước: 2C6H6 + 15O2 → 12CO2 +6H2O
b. Phản ứng thế Brom của benzen
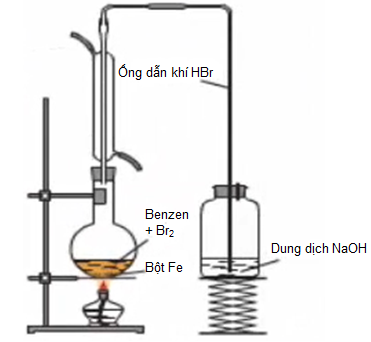
Benzen đã phản ứng với Brom có bột Fe làm xúc tác, tạo khí HBr không màu.
C6H6 + Br2 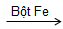
c. Phản ứng cộng của benzen
Benzen không tác dụng với Brom trong dung dịch, chứng tỏ benzen khó tham gia phản ứng cộng hơn etilen và axetilen. Tuy nhiên, trong điều kiện thích hợp. benzen có phản ứng cộng với một số chất như:
C6H6 + 3H2 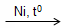
Kết luận: Do phân tử có cấu tạo đặc biệt nên benzen vừa có phản ứng thế, vừa có phản ứng cộng. Tuy nhiên, phản ứng cộng của benzen xảy ra khó hơn so với etilen và axetilen.
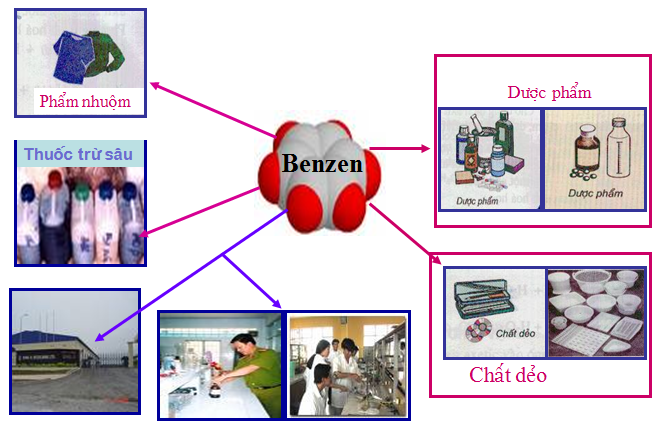
d. Ứng dụng
1.3. Tổng kết
2. Bài tập minh họa
2.1. Dạng 1: Phản ứng của benzen
Cho benzen tác dụng với brom tạo ra brombenzen:
a) Viết phương trình hóa học (có ghi rõ điều kiện phản ứng).
b) Tính khối lượng benzen cần dùng để điều chế 15,7gam brombenzen. Biết hiệu suất phản ứng đạt 80%.
Hướng dẫn giải
Phương trình hóa học:
C6H6 + Br2 \(\xrightarrow{{Fe}}\) C6H5Br + HBr
Số mol brombenzen là:
\(n_{C_{6}H_{5}Br}=\frac{ 15,7}{157 } =0,1 \ mol\)
nC6H6 = nbrombenzen = 0,1 mol
Khối lượng benzen đem phản ứng với hiệu suất 80% là:
\(m_{C_{6}H_{6}} = \frac{0,1 . 78 . 100}{80} = 9,75 \ g\)
2.2. Dạng 2: Xác định công thức
Đốt cháy hiđrocacbon A, người ta thu được CO2 và H2O theo tỉ lệ mCO2 : mH2O = 44 : 9. Biết A không làm mất màu dung dịch brom. Hỏi A là hiđrocacbon nào trong số các hiđrocacbon sau ?
CH ≡CH ; CH3 - CH3 ; CH2 = CH - C = CH ; CH2 = CH2 ;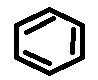
Hướng dẫn giải
Gọi công thức phân tử của A là: CxHy
CxHy → xCO2 + y/2 H2O
Theo đề bài ta có: 44x : 9y = 44 : 9
⇒ x : y = 1 : 1 ⇒ C6H6
Vậy A là .png)
3. Luyện tập
3.1. Bài tập tự luận
Câu 1: Khi có mặt bột sắt, benzen phản ứng với clo tương tự như phản ứng với brom. Hãy tính lượng clobenzen thu được khi cho 15,6 gam benzen tác dụng với clo dư khi có mặt bột Fe và đun nóng. Biết hiệu suất phản ứng đạt 80%.
Câu 2: Cho benzen tác dụng với brom xúc tác bột sắt thu được 3,925 g brombenzen. Tính khối lượng các chất tham gia, biết hiệu suất phản ứng là 75%.
Câu 3: Hãy cho biết chất nào trong các chất sau đây có thể làm mất màu dung dịch brom. Giải thích và viết phương trình hóa học (nếu có).
a) C6H6.
b) CH2 = CH – CH = CH2.
c) CH3 – C≡ CH.
d) CH3 – CH3.
3.2. Bài tập trắc nghiệm
Câu 1: Benzen không làm mất màu dung dịch brom vì
A. benzen là chất lỏng.
B. phân tử có cấu tạo vòng.
C. phân tử có 3 liên kết đôi.
D. phân tử có cấu tạo vòng, trong đó có 3 liên kết đôi xen kẽ ba liên kết đơn.
Câu 2: Cho benzen vào ống nghiệm đựng dung dịch brom, lắc đều sau đó để yên thấy chất lỏng trong ống nghiệm
A. là đồng nhất và có màu của dung dịch brom.
B. tách thành hai lớp và đều có màu.
C. tách thành hai lớp, lớp ở trên không màu.
D. là đồng nhất và không có màu.
Câu 3: Công thức cấu tạo của benzen có đặc điểm
A. Vòng 6 cạnh, 6 liên kết đơn.
B. Vòng 6 cạnh , 3 liên kết đôi xen kẽ với 3 liên kết đơn.
C. Vòng 6 cạnh , 2 liên kết đôi xen kẽ với 4 liên kết đơn.
D. Vòng 6 cạnh , 4 liên kết đôi xen kẽ với 2 liên kết đơn.
4. Kết luận
Sau bài học cần nắm:
- CTPT, CTCT, đặc điểm cấu tạo của benzen.
- Tính chất vật lí: Trạng thái, màu sắc, tính tan trong nước, khối lượng riêng, nhiệt độ sôi, độc tính.
- Tính chất hoá học của C6H6: Phản ứng thế với Br2 lỏng (có bột sắt, đun nóng), pứ cháy, pứ cộng hiđro và clo.
- Benzen được dùng làm nhiên liệu và dung môi trong tổng hợp hữu cơ.
Tham khảo thêm
- doc Hoá học 9 Bài 34: Khái niệm về hợp chất hữu cơ và hóa học hữu cơ
- doc Hoá học 9 Bài 35: Cấu tạo phân tử hợp chất hữu cơ
- doc Hoá học 9 Bài 36: Metan
- doc Hoá học 9 Bài 37: Etilen
- doc Hoá học 9 Bài 38: Axetilen
- doc Hoá học 9 Bài 40: Dầu mỏ và khí thiên nhiên
- doc Hoá học 9 Bài 41: Nhiên liệu
- doc Hoá học 9 Bài 42: Luyện tập chương 4 Hiđrocacbon - Nhiên liệu
- doc Hoá học 9 Bài 43: Thực hành: Tính chất của Hiđrocacbon



