Hoá học 10 Bài 27: Bài thực hành số 2 Tính chất hóa học của khí clo và hợp chất của Clo
Nội dung Bài thực hành số 2 Tính chất hóa học của khí clo và hợp chất của Clo củng cố các thao tác tiến hành thí nghiệm an toàn, hiệu quả, quan sát thí nghiệm Điều chế khí Clo; Tính tẩy màu của khí Clo ẩm; Điều chế axit clohidric; Thực nghiệm phân biệt các dung dịch. Đồng thời khắc sâu kiến thức về Clo và hợp chất của Clo.
Mục lục nội dung

1. Tóm tắt lý thuyết
1.1. Mục đích thí nghiệm
- Củng cố các thao tác làm thí nghiệm an toàn, hiệu quả, quan sát hiện tượng thí nghiệm, viết phương trình
- Củng cố kiến thức về clo và hợp chất của clo
1.2. Kỹ năng thí nghiệm
- Chỉ được làm thí nghiệm khi có sự hiện diện của giáo viên trong phòng thí nghiệm.
- Đọc kỹ hướng dẫn và suy nghĩ trước khi làm thí nghiệm.
- Luôn luôn nhận biết nơi để các trang thiết bị an toàn.
- Phải mặc áo choàng của phòng thí nghiệm.
- Phải mang kính bảo hộ.
- Phải cột tóc gọn lại.
- Làm sạch bàn thí nghiệm trước khi bắt đầu một thí nghiệm.
- Không bao giờ được nếm các hóa chất thí nghiệm. Không ăn hoặc uống trong phòng thí nghiệm.
- Không được nhìn xuống ống thí nghiệm.
- Nếu làm đổ hóa chất hoặc xảy ra tại nạn, báo cho giáo viên ngay lập tức.
- Rửa sạch da khi tiếp xúc với hóa chất.
- Nếu hóa chất rơi vào mắt, phải đi rửa mắt ngay lập tức.
- Bỏ chất thải thí nghiệm vào đúng nơi qui định như được hướng dẫn.
1.3. Cơ sở lý thuyết
a. Thí nghiệm 1: Điều chế khí Clo. Tính tẩy màu của khí Clo ẩm
Clo tan vào nước tạo ra HClO (axit có tính oxi hóa mạnh) làm mất màu quỳ tím.
Cl2 + H2O ⇔ HCl + HClO
b. Thí nghiệm 2: Điều chế axit clohidric
Nguyên tắc điều chế clo: oxi hóa 2Cl- → Cl2
Phương pháp điều chế clo: Cho HCl đặc tác dụng với các chất oxi hóa mạnh: KMnO4, MnO2…
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
Phương pháp điều chế axit clohidric: phương pháp sunfat
NaCl + H2SO4 → NaHSO4 + HCl↑
Sau đó dẫn khí HCl vào nước → Axit HCl
c. Thí nghiệm 3: Thực nghiệm phân biệt các dung dịch
Phương pháp nhận biết ion clorua: Dùng AgNO3 → kết tủa trắng AgCl
AgNO3 + HCl → AgCl↓ + HNO3
1.4. Dụng cụ thí nghiệm, hóa chất
a. Dụng cụ thí nghiệm
- Ống nghiệm, nút cao su, ống thủy tinh
- Đèn cồn, bông
- Giá sắt, kẹp gỗ
- Muỗng lấy hóa chất, pipet
b. Hóa chất
- KMnO4, quỳ tím, muối ăn
- Dung dịch HCl đặc, H2SO4 đặc
- Nước cất
- Dung dịch HCl, NaCl, HNO3
1.5. Các bước tiến hành thí nghiệm
a. Điều chế khí clo. Tính tẩy màu của khí clo ẩm
Cho vào ống nghiệm khô vài tinh thể KMnO4
Nhỏ tiếp vào ống vài giọt dd HCl đậm đặc.
Đậy ống nghiệm bằng nút cao su có có đính 1 băng giấy tẩm màu
Quan sát hiện tượng
b. Điều chế axit clohiđric
Dùng 2 ống nghiệm:
+ Ống 1: cho 1 ít muối ăn, sau đó rót dd H2SO4 đậm đặc vừa đủ để thấm ướt lớp muối ăn.
+ Ống 2: Thêm khoảng 8ml nước cất vào ống nghiệm
Lắp dụng cụ TN như hình vẽ
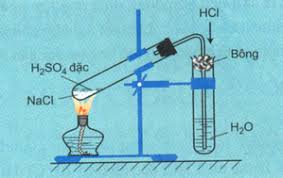
Đun nóng ống nghiệm 1 đến khi sủi bọt mạnh thì dừng.
Nhúng giấy quỳ tím vào dung dịch trong ống 2.
Quan sát hiện tượng
c. Bài tập thực nghiệm phân biệt các dung dịch
Phân biệt 3 dung dịch mất nhãn: HCl, NaCl, HNO3.
Hãy thảo luận nên các hóa chất, dụng cụ cần lựa chọn để phân biệt 3 dung dịch trên
2. Báo cáo thực hành
2.1. Thí nghiệm 1: Điều chế khí Clo. Tính tẩy màu của khí Clo ẩm
Hiện tượng: Có khí màu vàng thoát ra. Quỳ tím ẩm dần dần bị mất màu.
Giải thích: Khí màu vàng là do clo được tạo thành do phản ứng:
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
Sau đó clo tan vào nước (nước ở miếng quỳ tím) tạo ra HClO (axit có tính oxi hóa mạnh) làm mất màu quỳ tím.
Cl2 + H2O ⇔ HCl + HClO
2.2. Thí nghiệm 2: Điều chế axit clohidric
Hiện tượng: Dung dịch có chứa phenolphtalen từ màu hồng chuyển thành không màu.
Giải thích: Do HCl được giải phóng ra ở (1) tan vào nước tạo thành axit HCl làm dung dịch có chứa phenolphtalen từ màu hồng chuyển thành không màu.
NaCl + H2SO4 → NaHSO4 + HCl↑
2.3. Thí nghiệm 3: Thực nghiệm phân biệt các dung dịch
Nhận biết các dung dịch NaCl, HCl, HNO3
- Phương pháp 1
+ Bước 1: Dùng quỳ tím phân biệt được NaCl vì không có hiện tượng
+ Bước 2: Dùng tiếp dung dịch AgNO3 phân biệt được HCl vì có kết tủa trắng
Pthh: AgNO3 + HCl → AgCl↓ + HNO3
- Phương pháp 2
+ Bước 1: Dùng AgNO3 phân biệt được HNO3 vì không có hiện tượng
AgNO3 + HCl → AgCl↓ + HNO3
AgNO3 + NaCl → AgCl↓ + NaNO3
+ Bước 2: Dùng tiếp quỳ tím phân biệt được NaCl vì không có hiện tượng.
3. Luyện tập
Câu 1: Hình vẽ dưới đây mô tả thí nghiệm điều chế khí hidro halogenua:
Hai hidro halogenua (HX) có thể điều chế theo sơ đồ trên là
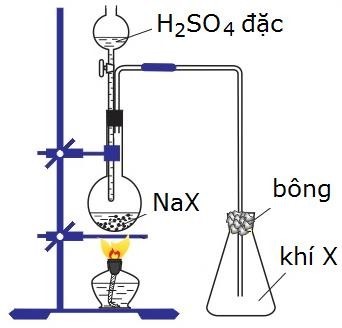
A. HBr và HI
B. HCl và HBr
C. HF và HCl
D. HF và HI
Câu 2: Cho hình vẽ mô tả thí nghiệm điều chế khí Cl2 từ MnO2 và dung dịch HCl:
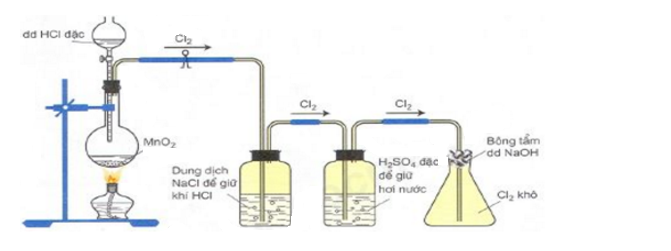
Phát biểu nào sau đây sai?
A. Có thể thay MnO2 bằng KMnO4
B. Bông tẩm dung dịch NaOH ngăn không cho khí Cl2 thoát ra.
C. Có thể thay dung dịch NaOH bằng dung dịch Ca(OH)2.
D. Có thể thay dung dịch NaCl bằng dung dịch KOH.
4. Kết luận
Nội dung bài học sẽ giúp các bạn hoàn thành được những thí nghiệm trong đời sống một cách thực tế nhất. Giúp các bạn nâng cao tinh thần học hỏi và thêm nhiều kiến thức hơn trong thực tế.
Tham khảo thêm
- doc Hoá học 10 Bài 21: Khái quát về nhóm halogen
- doc Hoá học 10 Bài 22: Clo
- doc Hoá học 10 Bài 23: Hiđro clorua - Axit clohiđric và muối clorua
- doc Hoá học 10 Bài 24: Sơ lược về hợp chất có oxi của clo
- doc Hoá học 10 Bài 25: Flo - Brom - Iot
- doc Hoá học 10 Bài 26: Luyện tập Nhóm halogen
- doc Hoá học 10 Bài 28: Bài thực hành số 3 Tính chất hóa học của Brom và Iot



