Hóa học 9 Bài 3: Tính chất hóa học của axit
Nội dung bài học tìm hiểu về Tính chất hoá học của axit như khả năng tác dụng với quỳ tím, với bazơ, oxit bazơ và kim loại.
Mục lục nội dung

1. Tóm tắt lý thuyết
1.1. Tính chất hóa học
- Axit làm đổi màu chất chỉ thị màu
Dung dịch axit làm quỳ tím chuyển thành màu đỏ.
- Axit tác dụng với kim loại:
Fe + 2HCl → FeCl2 + H2
Fe + H2SO4 → FeSO4 + H2
Dung dịch axit tác dụng được với một số kim loại tạo muối và giải phóng khí H2 (trừ Cu, Ag, Au)
Dung dịch HNO3, H2SO4 đặc tác dụng với nhiều kim loại nhưng không giải phóng H2
- Axit tác dụng với bazơ
Axit tác dụng với bazơ tạo muối và nước
Cu(OH)2 + H2SO4 → CuSO4 + 2H2O
- Axit tác dụng với oxit bazơ
Axit tác dụng với oxit bazơ tạo muối và nước.
Fe2O3 + 6HCl → 2FeCl2 + 3H2O
1.2. Axit mạnh, axit yếu
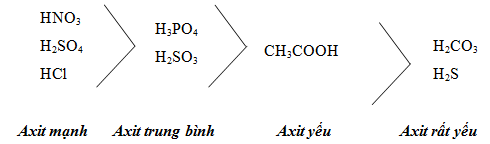
2. Ví dụ minh họa
2.1. Dạng 1: Viết phương trình hóa học về tính chất của axit
Có những chất sau: CuO, Mg, Al2O3, Fe(OH)3, Fe2O3. Hãy chọn một trong những chất đã cho tác dụng với dung dịch HCl sinh ra:
a) Khí nhẹ hơn không khí và cháy được trong không khí.
b) Dung dịch có màu xanh lam.
c) Dung dịch có màu vàng nâu.
d) Dung dịch không có màu.
Viết các phương trình hóa học.
Hướng dẫn giải
a. Khí nhẹ hơn không khí và cháy được trong không khí là khí H2.
Phương trình hóa học:
Mg + 2HCl → MgCl2 + H2↑
b. Dung dịch có màu xanh lam là dung dịch CuCl2.
Phương trình hóa học:
CuO + 2HCl → CuCl2 + H2O
c. Dung dịch có màu vàng nâu là dung dịch FeCl3.
Phương trình hóa học:
Fe(OH)3 + 3HCl → FeCl3 + 3H2O
Hoặc Fe2O3 + 6HCl → 2FeCl3 + 3H2O
d. Dung dịch không màu là các dung dịch MgCl2, AlCl3.
Phương trình hóa học:
Al2O3 + 6HCl → 2AlCl3 + 3H2O
Mg + 2HCl → MgCl2 + H2↑
2.2. Dạng 2: Xác định công thức của hóa học
Câu 1: Cho 32g một oxit kim loại hóa trị III tan hết trong 294g dung dịch H2SO4. Tìm công thức của oxit kim loại trên.
Hướng dẫn giải
Công thức cần tìm có dạng: X2O3
- Khối lượng H2SO4: m = 20.294100 = 58,8 g
- Số mol H2SO4 = 0,6 mol.
- Phương trình phản ứng:
X2O3 + 3H2SO4 → X2(SO4)3 + 3H2O
0,2 mol 0,6mol
Phân tử lượng của oxit: M =160.
Vậy oxit đó là Fe2O3.
Câu 2: Hãy tìm công thức hoá học của axit có thành phần khối lượng như sau :
H: 2,1%; N: 29,8%; O: 68,1%.
Hướng dẫn giải
Đặt công thức hoá học của axit là HxNyOz. Ta có:
x : y : z = 2,1 : 2,1 : 4,2 = 1 : 1 : 2
→ Công thức hoá học của axit là HNO2 (axit nitrơ).
2.3. Dạng 3: Bài tập về muối cacbonat và hiđrocacbonat tác dụng với axit
a. Cho từ từ dung dịch X chứa x mol HCl vào dung dịch Y chứa y mol Na2CO3 (x< 2y) thì thu được dung dịch Z chứa V lít khí. Tính V?
b. Nếu cho dung dịch Y vào dung dịch X thì thu được dung dịch A và V1 lít khí. Các phản ứng xảy ra hoàn toàn và thể tích khí đo ở điều kiện tiêu chuẩn. Tìm mối quan hệ giữa V1 với x, y.
Hướng dẫn giải
a. Cho từ từ HCl vào Na2CO3, phản ứng xảy ra như sau:
HCl + Na2CO3 → NaHCO3 + NaCl (1)
Nhưng theo đầu bài có khí bay ra nên phản ứng tiếp tục:
HCl + NaHCO3 → NaCl + CO2 + H2O (2)
Phản ứng (1) sẽ xảy ra hoàn toàn, sinh ra y mol NaHCO3.
Muốn phản ứng (2) xảy ra thì x > y.
Do đề bài cho x < 2y nên (2) phản ứng theo số mol của HCl còn lại.
Vậy V = 22,4.(x – y)
b. Khi cho Na2CO3 vào HCl:
Na2CO3 + 2HCl → 2NaCl + CO2 + H2O
1 mol 2 mol
y mol x mol
Đề bài cho x < 2y nên ta tính số mol khí sinh ra theo HCl:
V1 = x / 2 . 22,4
3. Luyện tập
3.1. Bài tập tự luận
Câu 1: Có những oxit sau: Fe2O3, SO2, CuO, MgO, CO2.
a) Những oxit nào tác dụng được với dung dịch H2SO4?
b) Những oxit nào tác dụng được với dung dịch NaOH?
c) Những oxit nào tác dụng được với H2O?
Viết các phương trình hoá học.
Câu 2: Hãy tìm công thức hoá học của những axit có thành phần khối lượng như sau :
a) H: 2,4%; S : 39,1%; O: 58,5%.
b) H: 3,7%; P: 37,8%; O: 58,5%.
Câu 3: Dung dịch X chứa a mol HCl , dung dịch Y chứa b mol Na2CO3 (a < 2b)
a) Cho rất từ từ X vào Y thì thu được V1 lít khí.
b) Cho Y vào X thì thu được V2 lít khí.
Lập thức tính V1, V2 theo a,b
3.2. Bài tập trắc nghiệm
Câu 1: Dung dịch H2SO4 tác dụng với chất nào tạo ra khí hiđro?
A. NaOH
B. Fe
C. CaO
D. CO2
Câu 2: Tính chất hóa học nào không phải của axit
A. Tác dụng với kim loại
B. Tác dụng với muối
C. Tác dụng với oxit axit
D. Tác dụng với oxit bazơ
Câu 3: Dung dịch tác dụng với CuO tạo ra sản phẩm là dung dịch có màu xanh lam:
A. Dung dịch NaOH
B. Dung dịch Na2CO3
C. Dung dịch HCl
D. Dung dịch Ca(OH)2
Câu 4: Dãy gồm các kim loại tác dụng được với dung dịch H2SO4 loãng là:
A. Fe, Cu, Mg
B. Zn, Fe, Cu
C. Zn, Fe, Al.
D. Fe, Zn, Ag
Câu 5: Nhóm chất tác dụng với nước và với dung dịch HCl là:
A. Na2O, SO3 , CO2
B. K2O, P2O5, CaO
C. BaO, SO3, P2O5
D. CaO, BaO, Na2O
4. Kết luận
Nội dung bài học được tóm tắt theo sơ đồ sau:

Tham khảo thêm
- docx Hoá học 9 Bài 1: Tính chất hóa học của oxit và Khái quát về sự phân loại oxit
- docx Hóa học 9 Bài 2: Một số oxit quan trọng
- docx Hóa học 9 Bài 4: Một số axit quan trọng
- docx Hóa học 9 Bài 5: Luyện tập tính chất hóa học của oxit và axit
- docx Hóa học 9 Bài 6: Thực hành: Tính chất hóa học của oxit và axit
- docx Hóa học 9 Bài 7: Tính chất hóa học của bazơ
- docx Hóa học 9 Bài 8: Một số bazơ quan trọng
- docx Hóa học 9 Bài 9: Tính chất hóa học của muối
- doc Hóa học 9 Bài 10: Một số muối quan trọng
- docx Hóa học 9 Bài 11: Phân bón hóa học
- docx Hóa học 9 Bài 12: Mối quan hẹ giữa các loại hợp chất vô cơ
- docx Hóa học 9 Bài 13: Luyện tập chương 1 Các loại hợp chất vô cơ
- docx Hóa học 9 Bài 14: Thực hành: Tính chất hóa học của bazơ và muối



