Giải bài tập SGK Hóa 11 Nâng cao Bài 62: Luyện tập Axit cacboxylic
Dưới đây là Hướng dẫn giải Hóa 11 SGK nâng cao Chương 9 Bài 62 Luyện tập Axit cacboxylic được eLib biên soạn và tổng hợp, nội dung bám sát theo chương trình SGK Hóa học 11 nâng cao giúp các em học sinh nắm vững phương pháp giải bài tập và ôn tập kiến thức hiệu quả hơn.
Mục lục nội dung
1. Giải bài 1 trang 259 SGK Hóa học 11 nâng cao
2. Giải bài 2 trang 260 SGK Hóa học 11 nâng cao
3. Giải bài 3 trang 260 SGK Hóa học 11 nâng cao
4. Giải bài 4 trang 260 SGK Hóa học 11 nâng cao
5. Giải bài 5 trang 260 SGK Hóa học 11 nâng cao
6. Giải bài 6 trang 260 SGK Hóa học 11 nâng cao
7. Giải bài 7 trang 260 SGK Hóa học 11 nâng cao

1. Giải bài 1 trang 259 SGK Hóa 11 nâng cao
Hãy điền các từ ngữ thích hợp vào các chỗ trống trong đoạn viết về cấu trúc nhóm cacboxyl sau đây:
“Nhóm cacboxyl được hợp bởi…(1)…và…(2)… Do mật độ electron dịch chuyển từ nhóm…(3)…về, nên nhóm…(4)…ở axit cacboxylic kém hoạt động hơn nhóm…(5)…ở anđehit và ở…(6)…, còn nguyên tử H ở nhóm…(7)…axit thì linh động hơn ở nhóm OH…(8)…và ở nhóm…(9)…phenol”.
A. ancol
B. OH
C. Nhóm hiđroxyl
D. Nhóm cacboxyl
E. C = O
G. xeton
Chú ý: mỗi cụm từ có thể dùng nhiều lần.
Phương pháp giải
Để giải bài tập này cần nắm vững cấu trúc nhóm cacboxyl
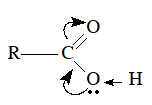
Hướng dẫn giải
(1) C=O
(2) nhóm hidroxyl
(3) OH
(4) C=O
(5) C=O
(6) xeton
(7) OH
(8) ancol
(9) OH
2. Giải bài 2 trang 260 SGK Hóa 11 nâng cao
Hãy so sánh nhiệt độ nóng chảy, nhiệt độ sôi và độ tan trong nước của anđhit và axit tương úng. Giải thích nguyên nhân dẫn tới sự khác nhau giữa chúng.
Phương pháp giải
Nhiệt độ sôi của ancol ,andehit ,acid ,xeton và este tương ứng như sau: acid >ancol > amin > andehit , xeton và este xeton > andehit
Hướng dẫn giải
- Nhiệt độ nóng chảy, nhiệt sôi của axit cao hơn anđehit có số C lượng ứng vì axit tạo được liên kết hiđro liên kết phân tử chặt chẽ.
- Axit có nhiệt độ sôi cao hơn anđehit có số C tương ứng vì axit tạo được liên kết hiđro với nước, giúp nó phân bón tốt trong nước.
3. Giải bài 3 trang 260 SGK Hóa 11 nâng cao
a) Hãy nêu những phản ứng ở nhóm axit cacboxylic, cho ví dụ minh họa.
b) Hãy nêu các phản ứng ở gốc hiđrocacbon của axit cacboxylic, cho ví dụ minh họa.
Phương pháp giải
- Tác dụng với bazơ, oxit bazơ tạo thành muối và nước
- Tác dụng với muối
- Tác dụng với kim loại trước hiđro
- Phản ứng thế nhóm –OH: Phản ứng giữa axit và ancol được gọi là phản ứng este hóa.
- Phản ứng tách nước liên phân tử
- Phản ứng thế ở gốc no
- Phản ứng thế ở gốc thơm
- Phản ứng cộng vào gốc không no
Hướng dẫn giải
Câu a: Những phản ứng nhóm chức axit cacbonyl.
Xét CH3COOH
Với thuốc thử màu: làm quỳ tím hóa đỏ.
- Tác dụng với một số kim loại giải phóng H2.
2CH3COOH + 2Na → 2CH3COONa + H2
- Tác dụng với bazơ, oxit bazơ.
CH3COOH + NaOH → CH3COONa + H2O
2CH3COOH + NaOH → CH3COONa + H2O
2CH3COOH + CaO → (CH3COO)2Ca + CO2 + H2O
- Tác dụng với muối của axit yếu hơn
2CH3COOH + CaCO3 → (CH3COO)2Ca + CO2 + H2O
- Tác dụng với ancol (phản ứng este hóa)
CH3COOH + C2H5OH ⇔ CH3COOC2H5 + H2O
Câu b: Những phản ứng ở gốc aixt.
- Phản ứng thế ở gốc hiđrocacbon (phản ứng H ở cacbon α)
CH3COOH + Cl2 → CH2ClCOOH + HCl
- Phản ứng cộng vào gốc không no.
CH2=CH-COOH + Br2 → CH2Br-CHBr-COOH
CH2=CH-COOH + H2 → CH3CH2COOH
4. Giải bài 4 trang 260 SGK Hóa 11 nâng cao
a) Hãy nêu phương pháp chung điều chế axit cacboxylic.
b) Hãy viết phương trình hóa học của phản ứng điều chế axit axetic trong công nghiệp từ metanol, từ etilen và từ axetilen. Hiện nay người ta sử dụng phương pháp nào là chính, vì sao?
Phương pháp giải
- Phương pháp lên men giấm
- Oxi hóa anđehit axetic
- Oxi hóa ankan
- Từ metanol
Hướng dẫn giải
Câu a: Phương pháp chung để điều chế axit cacboxyl: oxi hóa anđehit, ancol bậc một, đồng đẳng các benzeen, anken … ngoài ra để điều chế axit có thêm một nguyên tử cacbon so với ban đầu, người ta dùng dẫn xuất halogen, chuyển hợp chất này thành nitrin rồi thủy phân hoặc hợp chất hữu cơ magic rồi cho tác dụng với CO2 và thủy phân.
Câu b: Điều chế CH3COOH trong công nghiệp
Lên men giấm: CH3CH2OH + O2 → CH3COOH + H2O
Oxi hóa andehit axetic: 2CH3CHO + O2 → 2CH3COOH
Đi từ metaanol: CH3OH + CO → CH3COOH
Phương pháp điều chế CH3COOH chính hiện nay là đi từ CH3OH và CO, các hóa chất này được điều chế từ CH4 có sẵn trong thiên nhiên và khí dầu mỏ.
5. Giải bài 5 trang 260 SGK Hóa 11 nâng cao
Vì sao axit axetic được làm từ sản xuất nhiều hơn so với các axit hữu cơ khác.
Phương pháp giải
Dựa vào ứng dụng của axit axetic để trả lời câu hỏi
Hướng dẫn giải
CH3COOH được sản xuất nhiều hơn vì nó có nhiều ứng dụng như: axit cloaxetic (dùng tổng hợp chất diệt cỏ 2,4-D; 2,4,5-T ...), muối axetat của nhôm, crom, sắt (dùng làm chất cầm màu khi nhuộm vải, sợi), một số este (làm dược liệu, hương liệu, dung môi, ...), xenlulozơ axetat (chế tơ axetat), ...
6. Giải bài 6 trang 260 SGK Hóa 11 nâng cao
Hãy phân biệt các chất trong nhóm sau:
a) Etyl axetat, fomalin, axit axetic, etanol.
b) Các dung dịch: axeanđehit, glixerol, axit acrrylic và axit axetic.
Phương pháp giải
a) Dùng quỳ tím, AgNO3/NH3 và Na
b) Dùng quỳ tím, dung dịch brom và AgNO3/NH3
Hướng dẫn giải
Câu a:
- Dùng quỳ tím:
Nhận biết được CH3COOH vì làm quỳ tím hóa đỏ.
- Dùng AgNO3/NH3 (phản ứng tráng gương):
Nhận biết fomalin vì tạo kết tủa Ag.
HCHO + 4[Ag(NH3)2](OH) → (NH4)2CO3 + 4Ag + 6NH3 + 2H2O
- Dùng Na:
Nhận biết được C2H5OH vì sủi bọt khí H2, mẫu còn lại là etyl axetat.
2C2H5OH + 2Na → 2C2H5ONa + H2
Câu b: Dùng quỳ tím nhận được hai nhóm chất sau:
+ Nhóm làm quỳ tím hóa đỏ là CH2=CHCOOH và CH3COOH (nhóm I)
+ Nhóm không đổi màu quỳ tím CH3CHO và C3H8O3 (nhóm II)
- Nhóm I. Dùng dung dịch Br2 nhận biết được CH2=CHCOOH vì chất làm mất màu dung dịch Br2. Mẫu còn lại là CH3COOH.
CH2=CHCOOH + Br2 → CH2Br-CHBrCOOH
- Nhóm II. Dùng phản ứng tráng gương nhận biết được CH3CHO vì tạo ra kết tủa Ag. Mẫu còn lại là C3H8O3.
CH3CHO + 2[Ag(NH3)2](OH) → CH3COONH4 + 2Ag + 3NH3 + H2O
7. Giải bài 7 trang 260 SGK Hóa 11 nâng cao
Cho nước brom vào hỗn hợp gồm phenol và axit axetic, đến khi ngưng mất màu nước brom và thu được 33,1 g kết tủa trắng. Để trung hòa phần nước lọc, cần dùng hết 248 ml dung dịch NaOH 10% (D = 1,11 g/cm3). Xác định thành phần phần trăm hỗn hợp ban đầu.
Phương pháp giải
Ta có nNaOH = ? , n kết tủa = ?
Viết PTHH của phản ứng
⇒ nCH3COOH = ? ⇒ mCH3COOH = ?
nC6H5OH = n kết tủa = ?
⇒ mC6H5OH = ?
⇒ %mCH3COOH = ?
Hướng dẫn giải
\(\begin{array}{l}
{n_{NaOH}} = \frac{{248.1,11}}{{40.100}}.10 = 0,96mol\\
{n_ \downarrow } = \frac{{33,1}}{{331}} = 0,1mol
\end{array}\)
C6H5OH + 3Br2 → C6H2Br3OH + 3HBr (1)
Phần lọc nước gồm HBr: 0,3 mol và CH3COOH
HBr + NaOH → NaBr + H2O (2)
0,3 0,3
CH3COOH + NaOH → CH3COONa + H2O (3)
0,39 0,39 = (0,69 -0,3)
Từ (2) ⇒ nNaOH = 0,3 mol ⇒ nNaOH (3) = 0,69 – 0,3 = 0,39 mol
Từ (3) ⇒ nCH3COOH = 0,39 mol
⇒ mCH3COOH = 60.0,39 = 23,4 g
nC6H5OH = n kết tủa = 0,1 mol ⇒ mC6H5OH = 94 . 0,1 = 9,4 g
\(\% {m_{{C_6}{H_5}OH}} = \frac{{9,4}}{{23,4 + 9,4}}.100\% = 28,66\% \)
%mCH3COOH = 100% - 28,66% = 71,34%
8. Giải bài 8 trang 260 SGK Hóa 11 nâng cao
Kết quả phân tích nguyên tố cho thấy hợp chất A chứa 55,81%C, 7,01% H, còn lại là oxi. A là chất lỏng rất ít tan trong nước, không có vị chua, không làm mất màu nước brom, 1,72g A phản ứng vừa đủ với 20ml dung dịch NaOH 1M và tạo thành một hợp chất B có công thức phân tử C4H7O3Na. Khi đun nóng với dung dịch axit vô cơ, từ B lại tạo thành A.
a) Xác định công thức phân tử của A.
b) Từ công thức phân tử và tính chất của A, cho biết A thuộc hợp chất nào.
c) Viết công thức cấu tạo của A, B và phương trình hóa học đã nêu.
Phương pháp giải
Đặt công thức tổng quát của A: CxHyOz
⇒ A là este đơn chức mạch vòng ⇒ nA = nNaOH = ? ⇒ MA = ?
⇒ Công thức cấu tạo của A ⇒ Phương trình phản ứng
Hướng dẫn giải
Câu a: %O = 100 - (55,81 + 7,01) = 37,18%, số mol NaOH 0,02 mol
Đặt công thức tổng quát của A: CxHyOz
A không có vị chua ⇒ A không phải axit. A tác dụng với dung dịch kiềm tạo ra sản phẩm B: C4H7O3Na và A không mất màu dung dịch brom.
⇒ A là este đơn chức mạch vòng ⇒ nA = nNaOH = 0,02 mol ⇒ MA = 86 đvC
Công thức phân tử của A : C4H6O2
Câu b: A là este đơn chức mạch vòng. Công thức cấu tạo của A:
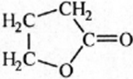
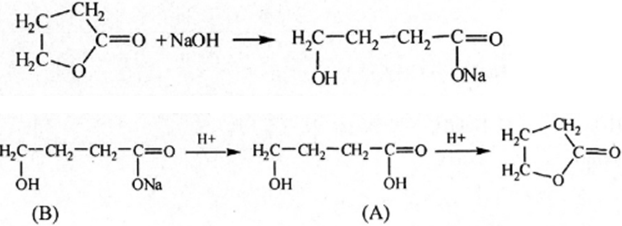
Câu c: Các phản ứng:
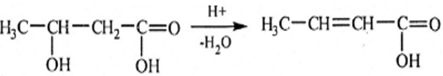
Nếu nhóm –OH ở vị trí 2 hoặc 3 thì khi đun nóng với axit vô cơ sẽ tạo ra axit không no:
9. Giải bài 9 trang 260 SGK Hóa 11 nâng cao
Tổng hợp isoamyl axetat (để làm “dầu chuối”) gồm 3 giai đoạn như sau:
A. Cho 60 ml axetic “băng” (axit 100% , D = 1,05 g/cm3), 108,6 ml 3 – metylbutan – 1 -ol (ancol isoamylic, D = 0,81g/cm3, nhiệt độ sôi xem bảng 8,3) và 1 ml H2SO4 vào bình cầu có lắp máy khuấy, ống sinh hàn (xem hình vẽ đầu chương) rồi đun sôi trong 8 giờ.
B. Sau khi để nguội, lắc hỗn hợp thu được với nước, chiết bỏ lớp nước, rồi lắc với dung dịch Na2CO3, chiết bỏ lớp dung dịch nước, lắc hỗn hợp được với nước, chiết bỏ lớp nước.
C. Chưng cất ở sản phẩm ở 142 – 143oC thu được 60 ml isoamyl axetat. Isoamyl axeta là chất lỏng D = 0,87 g/cm3, sôi ơ 142,5oC, có mùi thơm như mùi chuối chín (mùi dầu chuối).
a) Dùng hình vẽ để mô tả 3 giai đoạn A, B, C (xem hình 4.1; 4.2)
b) Viết phương trình hóa học phản ứng xảy ra ở giai đoạn A, B.
c) Tính hiệu suất của phản ứng.
Phương pháp giải
- Dựa vào so đồ phản ứng để mô tả hiện tượng
- Viết PTHH của phản ứng
- Tính toán dựa vào phương trình
Hướng dẫn giải
Câu a:
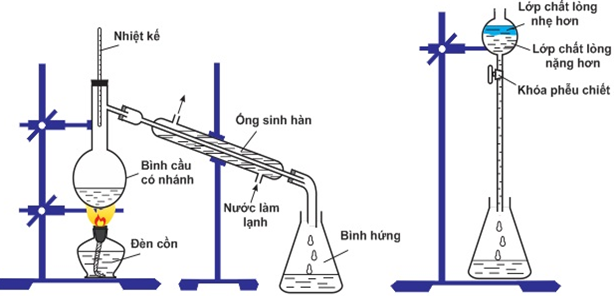
Cho axit axetic, ancol isoamylic, sunfuric vào đầu bình cầu đun trên bếp cách cát trong 4 giờ. Sản phẩm thu được ở bình tam giác.
Để nguội, rửa sạch phẩm nước, chiết bỏ H2SO4 và CH3COOH dư. Tiếp tục lắc hỗn hợp với Na2CO3 chiết và chưng cất sản phẩm ở 142 - 143oC thu được isoamyl axetat.
Câu b: CH3COOH + (CH3)2CH(CH2)OH ⇔ CH3COO(CH2)2CH(CH3)2 + H2O
2CH3COOH + Na2CO3 → 2CH3COONa + CO2 + H2O
H2SO4 + Na2CO3 → Na2SO4 + CO2 + H2O
Câu c: Khối lượng axit ban đầu: m = 60.1,05 = 63(g) ⇒ naxit = 1,05 mol
Khối lượng ancol isoamylic ban đầu:
m = 108,6.0,81 = 88(g) ⇒ nancol = 1 mol
Khối lượng este thu được m = 60.0,87 = 52(g) ⇒ neste = 0,4 mol
Ancol là chất thiếu, dựa vào ancol để tính hiệu suất.
CH3COOH + (CH3)2CH(CH2)2OH ⇔ CH3COO(CH2)2CH(CH3)2 + H2O
Hiệu suất phản ứng: H% = (0,4.100) :1 = 40%
Tham khảo thêm
- doc Giải bài tập SGK Hóa 11 Nâng cao Bài 58: Anđehit và xeton
- doc Giải bài tập SGK Hóa 11 Nâng cao Bài 59: Luyện tập Anđehit và xeton
- doc Giải bài tập SGK Hóa 11 Nâng cao Bài 60: Cấu trúc, danh pháp, tính chất vật lí Axit cacboxylic
- doc Giải bài tập SGK Hóa 11 Nâng cao Bài 61: TCHH, điều chế và ứng dụng Axit cacboxylic



