Giải bài tập SBT Hóa 9 Bài 9: Tính chất hóa học của muối
Dựa theo nội dung SBT Hóa học 9 eLib xin giới thiệu đến các em học sinh bài giải Tính chất hóa học của muối. Bài này sẽ giúp các em nắm vững được lý thuyết cũng như cách giải các bài tập đầy đủ, chi tiết và rõ ràng. Hy vọng đây sẽ là tài liệu tham khảo hữu ích với các em học sinh.
Mục lục nội dung

1. Giải bài 9.1 trang 11 SBT Hóa học 9
Thuốc thử dùng để phân biệt hai dung dịch natri sunfat và natri sunfit là
A. dung dịch bari clorua.
B. dung dịch axit clohiđric.
C. dung dịch chì nitrat.
D. dung dịch natri hiđroxit.
Phương pháp giải
Xem lại lý thuyết tính chất hóa học của muối, hiện tượng để nhận biết thường là kết tủa hoặc khí
Hướng dẫn giải
Khi nhỏ từ từ dung dịch HCl vào lần lượt thì:
+ Thấy sinh ra khí không màu là Na2SO3:
2HCl + Na2SO3 → 2NaCl + CO2 + H2O
+ Không hiện tượng là Na2SO4
Đáp án cần chọn là B.
2. Giải bài 9.2 trang 11 SBT Hóa học 9
a) Hãy cho biết những phản ứng hoá học nào có thể dùng để điều chế các muối sau (Bằng cách ghi dấu x (có) và dấu o (không) vào dấu ...):
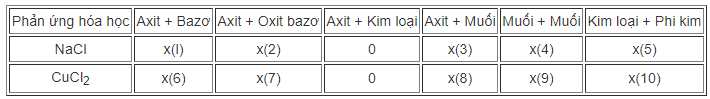
Viết các phương trình hoá học.
b) Vì sao có một số phản ứng hoá học trong bảng là không thích hợp cho sự điều chế những muối trên ?
Phương pháp giải
Xem lại lý thuyết tính chất hóa học của muối
Hướng dẫn giải
a) Viết các phương trình hóa học của phản ứng từ (1) đến (10)
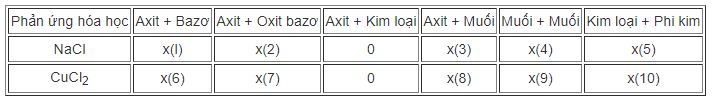
Phương trình:
(1) NaOH + HCl → NaCl + H2O
(2) Na2O + 2HCl → 2NaCl + H2O
(3) Na2S + 2HCl → 2NaCl + H2S↑
(4) Na2SO4 + BaCl2 → BaSO4↓ + 2NaCl
(5) 2Na + Cl2 → 2NaCl
(6) Cu(OH)2 + 2HCl → CuCl2 + 2H2O
(7) CuO + 2HCl → CuCl2 + H2O
(8) CuCO3 + 2HCl → CuCl2 + H2O + CO2
(9) CuSO4 + BaCl2 → BaSO4↓ + CuCl2
(10) Cu + Cl2 → CuCl2
b) Một số phản ứng hoá học không thích hợp để điều chế muối NaCl và CuCl2:
- Kim loại Na có phản ứng với axit HCl tạo muối NaCl. Nhưng người ta không dùng phản ứng này vì phản ứng gây nổ, nguy hiểm.
- Kim loại Cu không tác dụng với axit HCl.
3. Giải bài 9.3 trang 11 SBT Hóa học 9
Nếu chỉ dùng dung dịch NaOH thì có thể phân biệt được hai muối trong mỗi cặp chất sau được không ?
a) Dung dịch Na2SO4 và dung dịch Fe2(SO4)3.
b) Dung dịch Na2SO4 và dung dịch CuSO4.
c) Dung dịch Na2SO4 và dung dịch BaCl2.
Giải thích và viết phương trình hoá học.
Phương pháp giải
Xem lại lý thuyết tính chất hóa học của muối, nhận biết các chát dựa trên hiện tượng đặc trưng: kết tủa, khí, màu sắc...
Hướng dẫn giải
Dùng dung dịch NaOH có thể phân biệt được 2 muối trong những cặp chất:
a) Dung dịch Na2SO4 và dung dịch Fe2(SO4)3. Dung dịch muối nào tác dụng với dung dịch NaOH tạo ra kết tủa màu đỏ nâu, là muối Fe2(SO4)3:
Fe2(SO4)3 + 6NaOH → 2Fe(OH)3 + 3Na2SO4
b) Dung dịch Na2SO4 và dung dịch CuSO4 .Dung dịch muối nào tác dụng với dung dịch NaOH tạo ra kết tủa màu xanh, là muối CuSO4 :
CuSO4 + 2NaOH → Cu(OH)2 ↓+ Na2SO4
c) Dung dich Na2SO4 và dung dịch BaCl2: không dùng NaOH để nhận biết 2 dung dịch trên vì sau phản ứng các cặp chất không tồn tại.
4. Giải bài 9.4 trang 11 SBT Hóa học 9
Có thể dùng những phản ứng hoá học nào để chứng minh rằng thành phần của muối đồng(II) sunfat có nguyên tố đồng và gốc sunfat ?
Phương pháp giải
Có thể dựa vào màu sắc của một số kết tủa đặc trưng với đồng như Cu(OH)2: xanh lam, Cu: đỏ... còn gốc sunfat nhận biết bằng màu trắng đặc trưng của BaSO4
Hướng dẫn giải
Chọn những thuốc thử để nhận biết trong thành phần của muối đổng(II) suníat có chứa nguyên tố đồng và gốc sunfat:
- Nhận biết nguyên tố đồng. Dùng thuốc thử là kim loại hoạt động, thí dụ Fe, Zn...
Fe + CuSO4 → FeSO4 + Cu ↓
- Nhận biết gốc sunfat: Dùng thuốc thử là dung dịch muối bari, như BaCl2, Ba(NO3)2, Ba(OH)2 :
BaCl2 + CuSO4 → CuCl2 + BaSO4 ↓
5. Giải bài 9.5 trang 12 SBT Hóa học 9
Có những muối sau: CaCO3, CuSO4, MgCl2. Hãy cho biết muối nào có thể điều chế bằng phương pháp sau:
a) Axit tác dụng với bazơ.
b) Axit tác dụng với kim loại.
c) Muối tác dụng với muối.
d) Oxit bazơ tác dụng với oxit axit.
Viết các phương trình hoá học.
Phương pháp giải
Xem lại tính chất hóa học của một số hợp chất vô cơ đã học để điều chế muối (sản phẩm có chứa muối cần tìm).
Hướng dẫn giải
a) Axit tác dụng với bazơ: CaCO3, CuSO4, MgCl2.
H2CO3 + Ca(OH)2 → CaCO3 + 2H2O
Cu(OH)2 + H2SO4 → CuSO4 + 2H2O
Mg(OH)2 + 2HCl → MgCl2 + 2H2O
b) Axit tác dụng với kim loại: MgCl2, CuSO4 (dùng H2SO4 đặc).
Mg + 2HCl → MgCl2 + H2
Cu + 2H2SO4 (đặc) → CuSO4 + SO2 + H2O
c) Muối tác dụng với muối: CaCO3, CuSO4, MgCl2.
Thí dụ :
CaCl2 + Na2CO3 → CaCO3 + 2NaCl
CuCl2 + Ag2SO4 → CuSO4 + 2AgCl
BaCl2 + MgSO4 → BaSO4 + MgCl2
d) Oxit bazơ tác dụng với oxit axit: CaCO3.
CaO + CO2 → CaCO3
6. Giải bài 9.6 trang 12 SBT Hóa học 9
Trên bàn thí nghiệm có những chất rắn màu trắng là: Na2SO3, K2CO3, CaCO3, NaHCO3, Na2CO3, CaSO4.
Bạn em đã lấy một trong những chất trên bàn để làm thí nghiệm và có kết quả như sau :
Thí nghiệm 1: Cho tác dụng với dung dịch HCl, thấy giải phóng khí cacbon đioxit.
Thí nghiệm 2: Khi nung nóng cũng thấy giải phóng khí cacbon đioxit.
Thí nghiệm 3: Chất rắn còn lại sau khi nung ở thí nghiệm 2 tác dụng với dung dịch HCl cũng thấy giải phóng khí cacbon đioxit.
Em hãy cho biết bạn em đã lấy chất nào trên bàn để làm thí nghiệm. Viết các phương trình hoá học.
Phương pháp giải
Xem lại tính chất hóa học của muối
Hướng dẫn giải
TN1: cho biết chất đem làm thí nghiệm là muối cacbonat hoặc hiđrocacbonat (K2CO3, CaCO3, NaHCO3, Na2CO3).
TN2: cho biết muối đem làm thí nghiệm là CaCO3 hoặc NaHCO3, là những muối bị phân huỷ ở nhiệt độ cao.
TN3: cho biết sản phẩm thu được ở thí nghiệm 2 phải là muối cacbonat, không thể là canxi oxit CaO.
Vậy bạn em đã lấy muối NaHCO3 làm thí nghiệm.
NaHCO3+ HCl → NaCl + H2O + CO2↑
NaHCO3 to→ Na2CO3 + CO2↑ + H2O
Na2CO3 + 2HCl → 2NaCl + H2O + CO2↑
7. Giải bài 9.7 trang 12 SBT Hóa học 9
Biết 5 gam hỗn hợp hai muối là CaCO3 và CaSO4 tác dụng vừa đủ với 200 ml dung dịch HCl, sinh ra được 448 ml khí (đktc).
a) Tính nồng độ mol của dung dịch HCl đã dùng.
b) Tính thành phần phần trăm theo khối lượng của mỗi muối trong hỗn hợp ban đầu.
Phương pháp giải
Viết phương trình hóa học và tính toán theo phương trình hóa học.
Hướng dẫn giải
a) Chỉ có CaCO3 tác dụng với dung dịch HCl :
CaCO3 + 2HCl → CaCl2 + H2O + CO2
- Số mol HCl có trong dung dịch :
nHCl = 2nCO2 = 448/22400 x 2 = 0,04 mol
- Nồng độ mol của dung dịch HCl đã dùng :
CM = 1000 x 0,04/200 = 0,2 (mol/l)
b)Theo phương trình hoá học, số mol CaCO3 có trong hỗn hợp là
nCaCO3 = nCO2 = 0,02 mol
Khối lượng CaCO3 có trong hỗn hợp là :
mCaCO3 = 0,02 x 100 = 2 gam
Thành phần các chất trong hỗn hợp :
%mCaCO3 = 2x100%/5 = 40%
%mCaSO4 = 100% - 40% = 60%
8. Giải bài 9.8 trang 12 SBT Hóa học 9
Cho m gam hỗn hợp gồm CaCO3 và CaSO3 tác dụng với dung dịch HCl loãng dư thấy thoát ra 4,48 lít hỗn hợp hai khí ở đktc. Cho toàn bộ lượng hỗn hợp khí trên hấp thụ hết vào dung dịch Ba(OH)2 dư thấy tạo ra (m + a) gam kết tủa. Hãy tính a.
Phương pháp giải
Viết phương trình hóa học xảy ra:
2HCl + CaCO3 → CaCl2 + CO2 ↑+ H2O
2HCl + CaSO3 → CaCl2 + SO2 ↑+ H2O
CO2 + Ba(OH)2 → BaCO3 ↓+ H2O
SO2 + Ba(OH)2 → BaSO3 ↓+ H2O
Và tính theo phương trình hóa học.
Hướng dẫn giải
Theo các phương trình hóa học ta có:
nCaCO3 = nCO2 = nBaCO3; nCaCO3 = nSO2 = nBaSO3
→ mBaCO3, BaSO3 - mCaCO3, CaSO3 = nmuoi (137 - 40) = 97.nmuoi
mà nmuoi = nCO2, SO2 = 4,48/22,4 = 0,2 mol
⇒ (m + a) - m = 97.0,2 ⇒ a = 19,4g
Vậy giá trị a là 19,4g.
Tham khảo thêm
- doc Giải bài tập SBT Hóa 9 Bài 1: Tính chất hóa học của oxit
- doc Giải bài tập SBT Hóa 9 Bài 2: Một số oxit quan trọng
- doc Giải bài tập SBT Hóa 9 Bài 3: Tính chất hóa học của axit
- doc Giải bài tập SBT Hóa 9 Bài 4: Một số axit quan trọng
- doc Giải bài tập SBT Hóa 9 Bài 5: Luyện tập: Tính chất hóa học của oxit và axit
- doc Giải bài tập SBT Hóa 9 Bài 7: Tính chất hóa học của bazơ
- doc Giải bài tập SBT Hóa 9 Bài 8: Một số bazơ quan trọng
- doc Giải bài tập SBT Hóa 9 Bài 10: Một số muối quan trọng
- doc Giải bài tập SBT Hóa 9 Bài 11: Phân bón hóa học
- doc Giải bài tập SBT Hóa 9 Bài 12: Mối quan hệ giữa các loại hợp chất vô cơ



