Giải bài tập SBT Hóa 11 Bài 36: Luyện tập: Hiđrocacbon thơm
Giải bài tập Luyện tập chương 7: Hiđrocacbon thơm eLib sưu tầm và tổng hợp bên dưới đây. Tài liệu là lời giải hay, chi tiết và chính xác cho các bài tập trong SBT trang 51. Hi vọng tài liệu sẽ giúp ích cho quá trình học tập và nâng cao kiến thức của các bạn học sinh. Mời các bạn tham khảo tài liệu dưới đây chuẩn bị cho bài học sắp tới
Mục lục nội dung

1. Giải bài 7.12 trang 53 SBT Hóa học 11
Có bốn tên gọi : o-xilen, o-đimetylbenzen, 1,2-đimetylbenzen, etylbenzen. Đó là tên của
A. 1 chất.
B. 2 chất.
C. 3 chất.
D. 4 chất.
Phương pháp giải
Từ tên gọi, viết CTCT tương ứng với từng chất → Kết luận
Hướng dẫn giải
o-xilen; o- đimetylbenzen; 1,2-đimetylbenzen đều chỉ một chất
→ Đáp án cần chọn là B.
2. Giải bài 7.13 trang 53 SBT Hóa học 11
Có 5 công thức cấu tạo:
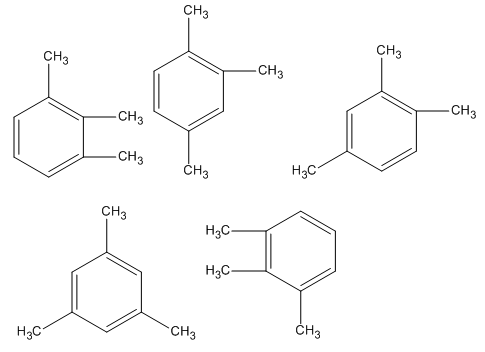
Đó là công thức của mấy chất ?
A. 1 chất.
B. 2 chất.
C. 3 chất.
D. 4 chất.
Phương pháp giải
Quan sát linh hoạt các vị trí của nhóm metyl trên vòng benzen
Hướng dẫn giải
Nếu đánh số theo thứ tự từ trên xuống dưới và từ trái qua phải. Ta có:
Công thức 1 giống công thức 5
Công thức 2 giống công thức 3
Vậy 5 công thức trên thực tế là 3 chất.
5 công thức trên biểu thị cho 3 chất.
Đáp án C
3. Giải bài 7.14 trang 53 SBT Hóa học 11
Cho vào ống nghiệm 2 ml nước brom. Nhỏ từ từ vào ống nghiệm đó 1 ml benzen. Trong ống nghiệm có 2 lớp chất lỏng : lớp dưới có thể tích lớn hơn và có màu vàng nâu, lớp trên không màu. Lắc kĩ ống nghiệm để hai lớp đó trộn vào nhau và sau đó để yên ống nghiệm. Trong ống lại thấy 2 lớp chất lỏng: lớp dưới có thể tích lớn hơn và không màu, lớp trên có màu. Hãy giải thích những hiện tượng vừa nêu.
Phương pháp giải
Xem lại lí thuyết về Benzen và đồng đẳng
Hướng dẫn giải
Benzen là chất lỏng không màu, nhẹ hơn nước, không tan trong nước nên nổi lên trên nước brom (nước brom có màu vàng nâu).
Khi lắc ống, vì benzen hoà tan brom tốt hơn nước nên brom chuyển từ nước brom sang dung dịch brom trong benzen. Vì thế khi để yên ống nghiệm, lớp dưới không màu và lớp trên có màu nâu.
4. Giải bài 7.15 trang 53 SBT Hóa học 11
A là một đồng đẳng của benzen có tỉ khối hơi so với metan bằng 5,75.
A tham gia các quá trình chuyển hóa theo sơ đồ sau:
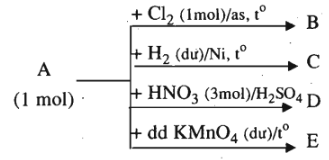
Trên sơ đồ chỉ ghi các chất sản phẩm hữu cơ (phản ứng còn có thể tạo ra các chất vô cơ).
Hãy viết phương trình hóa học của các quá trình chuyển hóa. Các chất hữu cơ viết dưới dạng công thức cấu tạo, kèm theo tên gọi.
Phương pháp giải
- Dựa vào tỉ khối hơi tìm MA → CTPT của A.
- Xem lại lí thuyết về Benzen và đồng đẳng để viết PTHH.
Hướng dẫn giải
MA = 5,75.16,0 = 92,0(g/mol)
⇒ 14n - 6 = 92 ⇒ n = 7
A là C7H8 hay C6H5-CH3 (toluen)
Phương trình hóa học:
C6H5-CH3 + Cl2 as→ C6H5CH2Cl + HCl (B: benzyl clorua)
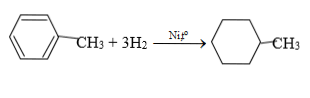
( C: metylxiclohexan)
.png)
D: TNT (trinitrotoluen)
C6H5-CH3 + 2KMnO4 (to) → C6H5-COOK + KOH + 2MnO2 + H2O
(E: kali benzoat)
5. Giải bài 7.16 trang 54 SBT Hóa học 11
Chất A là một đồng đẳng của benzen. Khi đốt cháy hoàn toàn 1,5 g chất A, người ta thu được 2,52 lít khí CO2 ( ở đktc ).
1. Xác định công thức phân tử chất A.
2. Viết các công thức cấu tạo có thể có của A kèm theo tên tương ứng.
3. Khi A tác dụng với Br2 có chất xúc tác Fe và nhiệt độ thì một nguyên tử H đính với vòng benzen bị thay thế bởi Br, tạo ra dẫn xuất monobrom duy nhất. Xác định công thức cấu tạo đúng của A.
Phương pháp giải
1. Viết PTHH: \({C_n}{H_{2n - 6}} + \dfrac{{3n - 3}}{2}{O_2} \to nC{O_2} + (n - 3){H_2}O\)
Tính theo PTHH → n → CTPT của A.
2. Xem lại lí thuyết về Benzen và đồng đẳng để viết các CTCT và gọi tên.
3. Do A tham gia phản ứng thế tạo dẫn xuất monobrom duy nhất nên A có cấu tạo đối xứng.
Hướng dẫn giải
1. \({C_n}{H_{2n - 6}} + \dfrac{{3n - 3}}{2}{O_2} \to nC{O_2} + (n - 3){H_2}O\)
Cứ ( 14n - 6) g A tạo ra n mol CO2
Cứ 1,50 g A tạo ra \(\dfrac{{2,52}}{{22,4}}\) = 0,1125 (mol) CO2
\(\dfrac{{14n - 6}}{{1,5}} = \dfrac{n}{{0,1125}} \Rightarrow n = 9\)
Công thức phân tử của A là C9H12
2. Các công thức cấu tạo
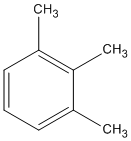
(1,2,3-trimetylbenzen)
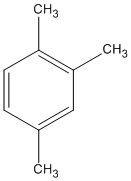
(1,2,4-trimetylbenzen)
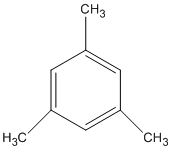
(1,3,5-trimetylbenzen)
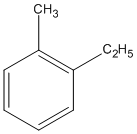
(1-etyl-2-metylbenzen)
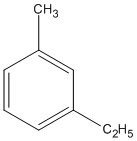
(1-etyl-3-metylbenzen)
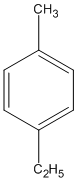
(1-etyl-4-metylbenzen)
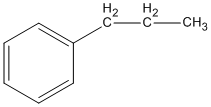
(propylbenzen)
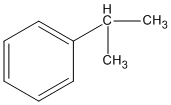
(isopropylbenzen)
3.
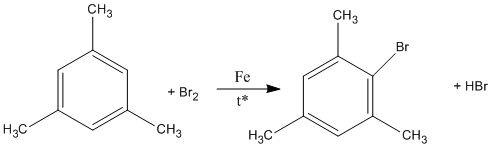
Chất A Sản phẩm thế duy nhất
6. Giải bài 7.17 trang 54 SBT Hóa học 11
Hỗn hợp M chứa benzen và xiclohexen. Hỗn hợp M có thể làm mất màu tối đa 75,0 g dung dịch brom 3,2%. Nếu đốt cháy hoàn toàn hỗn hợp M và hấp thụ tất cả sản phẩm cháy vào dung dịch Ca(OH)2 (lấy dư) thì thu được 21 g kết tủa. Tính phần trăm khối lượng từng chất trong hỗn hợp M.
Phương pháp giải
- Nx: Benzen không cộng hợp với brom trong nước brom nên có:
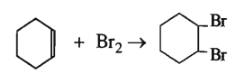
- Tính theo PTHH : Số mol xiclohexen = số mol Br2
- Đặt số mol benzen trong hỗn hợp M là x.
- Viết các PTHH:
2C6H6 + 15O2 → 12CO2 + 6H2O
2C6H10 + 17O2 → 12CO2 + 10H2O
CO2 + Ca(OH)2 →CaCO3 + H2O
+) Khai thác dữ kiện đề bài, lập phương trình ẩn x, giải phương trình \( \to\) phần trăm khối lượng từng chất trong hỗn hợp M.
Hướng dẫn giải
Benzen không cộng hợp với brom trong nước brom.
Xiclohexen có phản ứng:
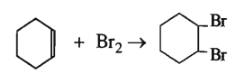
Số mol xiclohexen = số mol Br2 = \(\dfrac{{75.3,2}}{{100.160}}\) = 0,015 (mol).
Đặt số mol benzen trong hỗn hợp M là x.
2C6H6 + 15O2 → 12CO2 + 6H2O
x mol 6x mol
2C6H10 + 17O2 → 12CO2 + 10H2O
015 mol 0,09 mol
CO2 + Ca(OH)2 → CaCO3 + H2O
6x + 0,09 = \(\dfrac{{21}}{{100}}\) = 0,210 → x = 0,02
Khối lượng hỗn hợp M là : 0,02.78 + 0,015.82 = 2,79 (g).
% về khối lượng của C6H6 là: \(\dfrac{{0,02.78}}{{2,79}}\). 100% = 55,9%.
→ C6H10 chiếm 44,1% khối lượng hỗn hợp M.
7. Giải bài 7.18 trang 54 SBT Hóa học 11
Hỗn hợp A gồm hiđro và hơi benzen. Tỉ khối của A so với metan là 0,6. Dẫn A đi qua chất xúc tác Ni nung nóng thì chỉ xảy ra phản ứng làm cho một phần benzen chuyển thành xiclohexan. Hỗn hợp sau phản ứng có tỉ khối hơi so với metan là 0,75. Tính xem bao nhiêu phần trăm benzen đã chuyển thành xiclohexan.
Phương pháp giải
- Giả sử trong 1 mol hỗn hợp A có x mol C6H6 và (1 - x) mol H2.
- Dựa vào tỉ khối của A so với metan → x.
- Nếu cho 1 mol A qua chất xúc tác Ni, có n mol C6H6 phản ứng : C6H6 + 3H2 → C6H12
- Tính khối lượng trung bình của 1 mol khí sau phản ứng → n
→ phần trăm benzen đã chuyển thành xiclohexan.
Hướng dẫn giải
Giả sử trong 1 mol hỗn hợp A có x mol C6H6 và (1 - x) mol H2.
MA = 78x + 2(1 - x) = 0,6.16 = 9,6 (g/mol)
→ x = 0,1
Vậy, trong 1 mol A có 0,1 mol C6H6 và 0,9 mol H2.
Nếu cho 1 mol A qua chất xúc tác Ni, có n mol C6H6 phản ứng :
C6H6 + 3H2 → C6H12
n mol 3n mol n mol
Số mol khí còn lại là (1 - 3n) nhưng khối lượng hỗn hợp khí vẫn là 9,6 (g). Vì vậy, khối lượng trung bình của 1 mol khí sau phản ứng :
\(\overline M = \dfrac{{9,6}}{{1 - 3n}} = 0,75.16 = 12(g) \Rightarrow n = \dfrac{{0,2}}{3}\)
Tỉ lệ C6H6 tham gia phản ứng : \(\dfrac{{0,2}}{{3.0,1}}\). 100% = 67%.
Tham khảo thêm
- doc Giải bài tập SBT Hóa 11 Bài 35: Benzen và đồng đẳng. Một số hiđrocacbon thơm khác
- doc Giải bài tập SBT Hóa 11 Bài 37: Nguồn hiđrocacbon thiên nhiên
- doc Giải bài tập SBT Hóa 11 Bài 38: Hệ thống hóa về hiđrocacbon



