Giải bài tập SGK Hóa 9 Bài 32: Luyện tập chương 3 Phi kim - Sơ lược về bảng tuần hoàn các nguyên tố hóa học
Giải bài tập Luyện tập chương 3: Phi kim - Sơ lược về bảng tuần hoàn các nguyên tố hoá học được eLib sưu tầm và tổng hợp bên dưới đây. Tài liệu là lời giải hay, chi tiết và chính xác cho các bài tập trong SGK trang 103. Hi vọng tài liệu sẽ giúp ích cho quá trình học tập và nâng cao kiến thức của các bạn học sinh. Mời các bạn tham khảo tài liệu dưới đây chuẩn bị cho bài học sắp tới
Mục lục nội dung

1. Giải bài 1 trang 103 SGK Hóa học 9
Căn cứ vào sơ đồ sau:

Hãy viết phương trình hóa học với phi kim cụ thể là lưu huỳnh.
Phương pháp giải
Xem lại lí thuyết về phi kim đặc biệt là lý thuyết về lưu huỳnh.
Hướng dẫn giải
Phương trình hóa học với lưu huỳnh theo sơ đồ trên:
→ H2S
(2) 3S + 2Al → Al2S3
(3) S + O2 → SO2
2. Giải bài 2 trang 103 SGK Hóa học 9
Hãy viết các phương trình hoá học biểu diễn tính chất hoá học của clo theo sơ đồ 2.
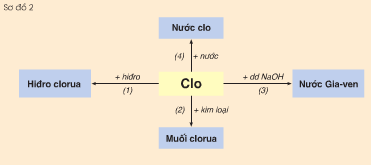
Phương pháp giải
Xem lại lí thuyết về clo, khả năng phản ứng
Hướng dẫn giải
Phương trình hóa học của biểu diễn tính chất hóa học của clo theo sơ đồ trên:
\(\begin{array}{*{20}{l}}
{(1)\;{H_2} + C{l_2} \to 2HCl}\\
{(2)\;2Fe + 3C{l_2} \to 2FeC{l_3}}\\
{(3)\;C{l_2} + 2NaOH \to NaCl + NaClO + {H_2}O}
\end{array}\)
3. Giải bài 3 trang 103 SGK Hóa học 9
Hãy viết các phương trình hoá học biểu diễn tính chất hoá học của cacbon và một số hợp chất của nó theo sơ đồ 3. Cho biết vai trò của cacbon trong các phản ứng đó.
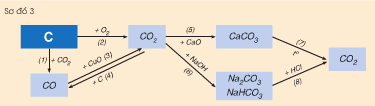
Phương pháp giải
Xem lại lí thuyết về cacbon, khả năng phản ứng của cacbon và hợp chất của cacbon
Hướng dẫn giải
Phương trình hóa học của các phản ứng:
\(\begin{array}{*{20}{l}}
{(1)\;C + C{O_2} \to 2CO}\\
{(2)\;C + {O_2} \to C{O_2}}\\
{(3)\;2CO + CuO \to Cu + C{O_2}}\\
{(4)\;C{O_2} + C \to 2CO}\\
{(5)\;C{O_2} + CaO \to CaC{O_3} \downarrow }\\
{(6)\;C{O_2} + 2NaOH \to N{a_2}C{O_3} + {H_2}O}\\
{(7)\;CaC{O_3} \to CaO + C{O_2}}\\
{(8)\;N{a_2}C{O_3} + {H_2}S{O_4} \to N{a_2}S{O_4} + C{O_2} \uparrow + {H_2}O}
\end{array}\)
Vai trò của C trong phản ứng (1), (2) và (4) là chất khử.
4. Giải bài 4 trang 103 SGK Hóa học 9
Nguyên tố A có số hiệu nguyên tử là 11, chu kì 3, nhóm I trong bảng tuần hoàn các nguyên tố hoá học. Hãy cho biết:
- Cấu tạo nguyên tử của A.
- Tính chất hoá học đặc trưng của A.
- So sánh tính chất hoá học của A với các nguyên tố lân cận.
Phương pháp giải
Xem lại lí thuyết về bảng tuần hoàn các nguyên tố hóa học
Hướng dẫn giải
a. Cấu tạo nguyên tử:
- Số hiệu nguyên tử là 11 nên A có điện tích hạt nhân là 11+, có 11 eletron trong nguyên tử, nằm ở ô số 11 trong bảng tuần hoàn các nguyên tố hóa học
- Chu kì 3 nên A có 3 lớp electron
- Nhóm I nên A có 1 electron lớp ngoài cùng
b. Tính chất hóa học đặc trưng: A là một kim loại mạnh. Trong phản ứng hóa học, Na là chất khử mạnh
+ Tác dụng với phi kim:
\(4Na + {O_2} \to 2N{a_2}O\)
\(2Na + C{l_2} \to 2NaCl\)
+ Tác dụng với dung dịch axit:
\(2Na + 2HCl \to 2NaCl + {H_2}\)
+ Tác dụng với nước: Nguyên tố Na ngoài tính chất hóa học chung của kim loại còn có tính chất hóa học đặc trưng là tác dụng với nước ở nhiệt độ thường.
\(2Na + 2{H_2}O \to 2NaOH + {H_2}\)
+ Tác dụng với dung dịch muối: Na tác dụng với dung dịch CuSO4 thì Na tác dụng với nước trong dung dịch trước
\(2Na + 2{H_2}O \to 2NaOH + {H_2}\)
\(2NaOH + CuS{O_4} \to Cu{(OH)_2} + N{a_2}S{O_4}\)
c. So sánh tính chất hóa học của Na với các nguyên tố lân cận:
Na có tính chất hóa học mạnh hơn Mg (nguyên tố đứng sau Na trong cùng chu kì) và mạnh hơn nguyên tố Li (nguyên tố đứng trên Na trong cùng một nhóm) nhưng yếu hơn nguyên tố K (nguyên tố đứng dưới Na trong cùng một nhóm)
5. Giải bài 5 trang 103 SGK Hóa học 9
a) Hãy xác định công thức của một loại oxit sắt, biết rằng khi cho 32 gam oxit sắt này tác dụng hoàn toàn với khí cacbon oxit thì thu được 22,4 gam chất rắn. Biết khối lượng mol phân tử của oxit sắt là 160 gam/mol.
b) Chất khí sinh ra được hấp thụ hoàn toàn bằng nước vôi trong dư. Tính khối lượng kết tủa thu được.
Phương pháp giải
a) Gọi công thức oxit sắt : FexOy
nOxit sắt = 32: 160 = 0,2 mol
nFe=x. noxit= x. 0,2 mol
Theo đề bài : x.0,2.56=22,4 → x
Do Moxit = 160 → y
b) Phương trình hóa học: Ca(OH)2 + CO2 → CaCO3+ H2O (2)
n CO2 = y. n oxit sắt
nCaCO3 = nCO2 → mCaCO3
Hướng dẫn giải
a) Phương trình hóa học: FexOy + yCO → xFe + yCO2 (1)
Công thức của oxit sắt:
nOxit sắt = 32 : 160 = 0,2 mol
nFe = x. noxit = x. 0,2 mol
Theo đề bài : x.0,2.56=22,4 → x = 2
Do Moxit = 160 → 2.56 + 16.y = 160 => y = 3
Công thức của oxit là Fe2O3
b) Phương trình hóa học: Ca(OH)2 + CO2 → CaCO3+ H2O (2)
Khối lượng kết tủa thu được:
Theo phương trình (1) nCO2 = y. n oxit sắt = 3. 0,2 = 0,6 mol
nCaCO3 = nCO2 = 0,6 mol → mCaCO3 = 0,6. 100 = 60 gam
6. Giải bài 6 trang 103 SGK Hóa học 9
Cho 69,6 gam MnO2 tác dụng với dung dịch HCl đặc dư thu được một lượng khí X. Dẫn khí X vào 500 ml dung dịch NaOH 4M thu được dung dịch A. Tính nồng độ mol của các chất trong dung dịch A. Giả thiết rằng thể tích dung dịch sau phản ứng thay đổi không đáng kể.
Phương pháp giải
nMnO2 = ?, nNaOH = ?
Tính theo PTHH của phản ứng:
\(Mn{O_2} + 4HCl \to MnC{l_2} + C{l_2} + 2{H_2}O\) (1)
\(C{l_2} + 2NaOH \to NaCl + NaClO + {H_2}O\) (2)
Ta thấy \(\dfrac{{{n_{C{l_2}}}}}{1} = \dfrac{{0,8}}{1} < \dfrac{{{n_{NaOH}}}}{2} = \dfrac{2}{2} \to \)NaOH dư, Cl2 phản ứng hết nên mọi tính toán theo số mol Cl2
Hướng dẫn giải
\({n_{Mn{O_2}}} = \dfrac{{69,6}}{{87}} = 0,8\,\,mol\)
Đổi 500 ml = 0,5 lít
\({n_{NaOH}} = 0,5.4 = 2\,\,mol\)
Phương trình phản ứng:
\(Mn{O_2} + 4HCl \to MnC{l_2} + C{l_2} + 2{H_2}O\) (1)
Theo phương trình (1): \({n_{C{l_2}}} = {n_{Mn{O_2}}} = 0,8\,\,mol\)
Phương trình phản ứng:
\(C{l_2} + 2NaOH \to NaCl + NaClO + {H_2}O\) (2)
Ta thấy \(\dfrac{{{n_{C{l_2}}}}}{1} = \dfrac{{0,8}}{1} < \dfrac{{{n_{NaOH}}}}{2} = \dfrac{2}{2} \to \)NaOH dư, Cl2 phản ứng hết nên mọi tính toán theo số mol Cl2
Theo phương trình (2): \({n_{NaCl}} = {n_{C{l_2}}} = 0,8\,\,mol\)
\( \to {C_{M(NaCl)}} = \dfrac{{0,8}}{{0,5}} = 1,6M\)
Theo phương trình (2): \({n_{NaClO}} = {n_{C{l_2}}} = 0,8\,\,mol\)
\( \to {C_{M(NaClO)}} = \dfrac{{0,8}}{{0,5}} = 1,6M\)
Theo phương trình (2): \({n_{NaOH(phản ứng)}} = 2{n_{C{l_2}}} = 2.0,8 = 1,6\,\,mol\)
\( \to {n_{NaOH(dư)}} = 2 - 1,6 = 0,4\,\,mol\)
\( \to {C_{M(NaOH\,\,dư)}} = \dfrac{{0,4}}{{0,5}} = 0,8M\)
Tham khảo thêm
- doc Giải bài tập SGK Hóa 9 Bài 25: Tính chất của phi kim
- doc Giải bài tập SGK Hóa 9 Bài 26: Clo
- doc Giải bài tập SGK Hóa 9 Bài 27: Cacbon
- doc Giải bài tập SGK Hóa 9 Bài 28: Các oxit của cacbon
- doc Giải bài tập SGK Hóa 9 Bài 29: Axit cacbonic và muối cacbonat
- doc Giải bài tập SGK Hóa 9 Bài 30: Silic và Công nghiệp silicat
- doc Giải bài tập SGK Hóa 9 Bài 31: Sơ lược về bảng tuần hoàn các nguyên tố hóa học



