Giải bài tập SGK Hóa 12 Nâng cao Bài 58: Hóa học và vấn đề môi trường
Hướng dẫn Giải bài tập Hóa học 12 nâng cao Bài 58 dưới đây sẽ giúp các em học sinh nắm vững phương pháp giải bài tập và ôn luyện tốt kiến thức về hóa học và vấn đề môi trường. Mời các em cùng theo dõi.
Mục lục nội dung

Giải bài tập SGK Hóa 12 Nâng cao Bài 58: Hóa học và vấn đề môi trường
1. Giải bài 1 trang 272 SGK Hóa 12 nâng cao
Trường hợp nào sau đây được coi là không khí sạch?
A. Không khí chứa 78% N2, 21% O2, 1% hỗn hợp CO2, H2O, H2
B. Không khí chứa 78% N2, 18% O2, 4% hỗn hợp CO2, SO2, HCl
C. Không khí chứa 78% N2, 20% O2, 2% hỗn hợp CH4, bụi và CO2
D. Không khí chứa 78% N2, 16% O2, 3% hỗn hợp CO2, 1% CO, 1% SO2
Phương pháp giải
Để chọn đáp án đúng cần ghi nhớ không khí sạch chứa 78% N2, 21% O2, 1% hỗn hợp CO2, H2O, H2
Hướng dẫn giải
Trường hợp được coi là không khí sạch:
Không khí chứa 78% N2, 21% O2, 1% hỗn hợp CO2, H2O, H2
⇒ Đáp án A.
2. Giải bài 2 trang 272 SGK Hóa 12 nâng cao
Trường hợp nào sau đây được coi là nước không bị ô nhiễm?
A. Nước ruộng lúa có chứa khoảng 1% thuốc trừ sâu và phân bón hóa học.
B. Nước thải nhà máy có chứa nồng độ lớn các ion kim loại nặng như Pb2+, Cd2+, Hg2+, Ni2+
C. Nước thải từ bệnh viện, khu vệ sinh chứa các bi khuẩn gây bệnh.
D. Nước sinh hoạt từ các nhà máy nước hoặc nước giếng khoan không chứa các độc tố như asen, sắt... quá mức cho phép.
Phương pháp giải
Để chọn đáp án đúng cần ghi nhớ: Nước sinh hoạt từ các nhà máy nước hoặc nước giếng khoan không chứa các độc tố như asen, sắt... quá mức cho phép được coi là nước không bị ô nhiễm.
Hướng dẫn giải
Nước sinh hoạt từ các nhà máy nước hoặc nước giếng khoan không chứa các độc tố như asen, sắt... quá mức cho phép được coi là nước không bị ô nhiễm.
⇒ Đáp án D.
3. Giải bài 3 trang 272 SGK Hóa 12 nâng cao
Môi trường không khí, đất, nước xung quanh một số nhà máy hóa chất thường bị ô nhiễm nặng bởi khí độc, ion kim loại nặng và các hóa chất. Biện pháp nào sau đây không thể chống ô nhiễm môi trường?
A. Có hệ thống xử lí chất thải trước khi xả ra ngoài hệ thống không khí, sông, hồ, biển.
B. Thực hiện chu tình khép kín để tận dụng chất thải một cách có hiệu quả.
C. Thay đổi công nghệ sản xuất, sử dụng nhiên liệu sạch.
D. Xả chất thải trựa tiếp ra ngoài không khí, sông và biển lớn.
Phương pháp giải
Để chọn đáp án đúng cần ghi nhớ: Biện pháp xả chất thải trựa tiếp ra ngoài không khí, sông và biển lớn không thể chống ô nhiễm môi trường.
Hướng dẫn giải
Môi trường không khí, đất, nước xung quanh một số nhà máy hóa chất thường bị ô nhiễm nặng bởi khí độc, ion kim loại nặng và các hóa chất. Biện pháp xả chất thải trựa tiếp ra ngoài không khí, sông và biển lớn không thể chống ô nhiễm môi trường.
⇒ Đáp án D.
4. Giải bài 4 trang 273 SGK Hóa 12 nâng cao
Sau khi tiến hành thí nghiệm nghiên cứu HNO3 tác dụng với Cu, thường có những chất thải nào? Nêu biện pháp xử lí những chất thải này trong phòng thí nghiệm.
Phương pháp giải
- Sau thí nghiệm Cu tác dụng với HNO3 thường thu được khí NO hoặc NO2, muối Cu(NO3)2 và HNO3 còn dư.
- Xử lí: Trước khi làm thí nghiệm cần chuẩn bị dung dịch kiềm hoặc nước vôi và bông tẩm dung dịch kiềm, dung dịch trong ống nghiệm cần xử lý bằng nước vôi hoặc dung dịch kiềm.
Hướng dẫn giải
Sau thí nghiệm Cu tác dụng với HNO3 thường thu được khí NO hoặc NO2, muối Cu(NO3)2 và HNO3 còn dư.
Biện pháp xử lí những chất thải này:
- Trước khi làm thí nghiệm cần chuẩn bị dung dịch kiềm hoặc nước vôi và bông tẩm dung dịch kiềm (nút ống nghiệm bằng bông này để hấp thụ khí sinh ra hoặc cho khí sinh ra vào dung dịch kiềm):
2NO + O2 → 2NO2
2NO2 + 2NaOH → NaNO2 + NaNO3 + H2O
- Phần dung dịch trong ống nghiệm cần xử lý bằng nước vôi hoặc dung dịch kiềm:
Cu(NO3)2 + 2NaOH → 2NaNO3 + Cu(OH)2
HNO3 + NaOH → NaNO3 + H2O
5. Giải bài 5 trang 273 SGK Hóa 12 nâng cao
Sau bài thực hành hóa học, trong một số chất thải ở dạng dung dịch chứa các ion: Cu2+, Zn2+, Fe3+, Pb2+, Hg2+,...
Dùng chất nào sau đây để xử lí sơ bộ những chất thải trên?
A. Nước vôi dư.
B. HNO3.
C. Giấm ăn.
D. Etanol.
Phương pháp giải
Để chọn đáp án đúng cần ghi nhớ: dùng nước vôi dư để xử lí sơ bộ những chất thải trên vì nước vôi dư có môi trường kiềm, sẽ làm kết tủa các ion kim loại nặng.
Hướng dẫn giải
Ta dùng nước vôi dư để xử lí sơ bộ những chất thải trên vì nước vôi dư có môi trường kiềm, sẽ làm kết tủa các ion kim loại nặng.
⇒ Đáp án A.
6. Giải bài 6 trang 273 SGK Hóa 12 nâng cao
a. Khi đánh vỡ nhiệt kế làm bầu thuỷ ngân bị vỡ ta cần dùng bột lưu huỳnh rắc lên thủy ngân rồi gom lại. Hãy giải thích và viết phương trình hóa học?
b. Trong công nghiệp để xứ lí khí thải H2S người ta hấp thụ và oxi hóa H2S theo sơ đồ sau:
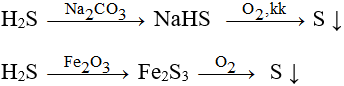
Hãy giải thích và viết các phương trình của phản ứng xảy ra.
Phương pháp giải
a. Lưu huỳnh phản ứng với thủy ngân ở điều kiện thường tạo muối thủy ngân sunfua không độc
b. Dựa vào chất sản phẩm và chất tham gia phản ứng để suy ra các chất còn lại và phương trình hóa học.
Hướng dẫn giải
Câu a
Lưu huỳnh phản ứng với thủy ngân ở điều kiện thường tạo muối thủy ngân sunfua không độc:
Hg + S → HgS
→ Khi đánh vỡ nhiệt kế làm bầu thuỷ ngân bị vỡ ta cần dùng bột lưu huỳnh rắc lên thủy ngân rồi gom lại.
Câu b
Trong công nghiệp để xứ lí H2S, người ta hấp thụ và oxi hóa bằng cách biến nó thành bột S không độc.
Phương trình hoá học:
2H2S + Na2CO3 → 2NaHS + CO2 + H2O
2NaHS + O2 → 2NaOH + 2S
3H2S + Fe2O3 → Fe2S3 + 3H2O
2Fe2S3 + 3O2 → 2Fe2O3 + 6S
7. Giải bài 7 trang 273 SGK Hóa 12 nâng cao
Để đánh giá độ nhiễm bẩn không khí của một nhà máy, người ta tiến hành như sau:
Lấy 2 lít không khí rồi dẫn qua dung dịch Pb(NO3)2 dư thì thu được 0,3585 mg chất kết tủa màu đen.
a. Hãy cho biết hiện tượng đó đã chứng tỏ trong không khí đã có khí nào trong các khí sau đây?
A. H2S
B. CO2
C. SO2
D. NH3
b. Viết phương trình của các phản ứng hóa học xảy ra. Tính hàm lượng khí có trong không khí. Coi hiệu suất phản ứng là 100%.
c. Hãy xem xét sự nhiễm bẩn không khí trên có vượt mức cho phép không? Nếu biết hàm lượng cho phép là 0,01 mg/lit.
Phương pháp giải
a. Khi lấy không khí rồi dẫn qua dung dịch Pb(NO3)2 dư thì thu được chất kết tủa màu đen (PbS) chứng tỏ trong không khí chứa H2S.
b. Dựa vào phương trình hóa học tính số mol H2S, suy ra hàm lượng khí có trong không khí.
c. So sánh hàm lượng khí tính ở câu b với hàm lượng cho phép, đưa ra kết luận.
Hướng dẫn giải
Câu a
Khi lấy không khí rồi dẫn qua dung dịch Pb(NO3)2 dư thì thu được chất kết tủa màu đen (PbS) chứng tỏ trong không khí chứa H2S.
→ Đáp án A.
Câu b
Phương trình hóa học:
Pb(NO3)2 + H2S → PbS↓ + 2HNO3.
mol
Khối lượng H2S có trong không khí:
mH2S = 1,5.10-6.34 = 51.10-6 gam = 0,051 mg.
Câu c
Sự nhiễm bẩn không khí bởi H2S vượt quá mức cho phép là 0,01 mg/lit tới 2,55 lần.
Tham khảo thêm
- doc Giải bài tập SGK Hóa 12 Nâng cao Bài 56: Hóa học và vấn đề phát triển kinh tế
- doc Giải bài tập SGK Hóa 12 Nâng cao Bài 57: Hóa học và vấn đề xã hội




