Giải bài tập SGK Hóa 12 Nâng cao Bài 28: Kim loại kiềm
Hướng dẫn Giải bài tập Hóa học 12 nâng cao Bài 28 dưới đây sẽ giúp các em học sinh nắm vững phương pháp giải bài tập và ôn luyện tốt kiến thức về tính chất của kim loại kiềm. Mời các em cùng theo dõi.
Mục lục nội dung

1. Giải bài 1 trang 152 SGK Hóa 12 nâng cao
Nguyên tử của các kim loại trong nhóm IA khác nhau về:
A. Số electron lớp ngoài cùng của nguyên tử.
B. Cấu hình electron nguyên tử.
C. Số oxi hóa của nguyên tử trogn hợp chất.
D. Kiểu mạng tinh thể của đơn chất.
Phương pháp giải
Để lựa chọn đáp án phù hợp cần nắm rõ đặc điểm cấu tạo của kim loại kiềm.
Hướng dẫn giải
Nguyên tử của các kim loại trong nhóm IA khác nhau về cấu hình electron nguyên tử.
⇒ Đáp án B.
2. Giải bài 2 trang 152 SGK Hóa 12 nâng cao
Câu nào mô tả đúng sự biến đổi tính chất của các kim loại kiềm theo chiều điện tích hạt nhân tăng dần?
A. Bán kính nguyên tử giảm dần
B. Nhiệt độ nóng chảy tăng dần.
C. Năng lượng ion hóa của I1 của nguyên tử giảm dần.
D. Khối lượng riêng của đơn chất giảm dần.
Phương pháp giải
Để lựa chọn đáp án phù hợp cần nắm rõ sự biến đổi tuần hoàn tính chất của các kim loại kiềm theo chiều điện tích hạt nhân tăng dần về bán kính, nhiệt độ nóng chảy, năng lượng ion hóa, khối lượng riêng.
Hướng dẫn giải
Câu mô tả đúng sự biến đổi tính chất của các kim loại kiềm theo chiều điện tích hạt nhân tăng dần là:
Năng lượng ion hóa của I1 của nguyên tử giảm dần.
⇒ Đáp án C.
3. Giải bài 3 trang 152 SGK Hóa 12 nâng cao
Kim loại Na ở nhiệt độ cao tác dụng với khí oxi khô và dư, tạo ra peoxit. Khi hợp chất này tác dụng với nước, thu được dung dịch natri hiđroxit. Người ta cũng có thể thu đựơc dung dịch natri hiđroxit bằng cách cho kim loại natri tác dụng với nước. Viết các phương trình hóa học.
Phương pháp giải
Để viết phương trình hóa học cần dựa vào dữ kiện đề bài mô tả ở trên, xác định sản phẩm và chất tham gia phản ứng.
Hướng dẫn giải
Các phương trình hóa học:
2Na + O2 \(\xrightarrow{{{t^o}}}\) Na2O2
2Na2O2 + 2H2O → 4NaOH + O2
2Na + 2H2O → 2NaOH + H2
4. Giải bài 4 trang 153 SGK Hóa 12 nâng cao
Hãy giải thích vì sao kim loại kiềm có khối lượng riêng nhỏ, nhiệt độ nóng chảy thấp và năng lượng ion hóa I1 thấp.
Phương pháp giải
Để giải thích lí do kim loại kiềm có khối lượng riêng nhỏ, nhiệt độ nóng chảy thấp và năng lượng ion hóa I1 thấp cần dựa vào đặc điểm cấu tạo mạng tinh thể và lớp eletron ngoài cùng.
Hướng dẫn giải
Giải thích:
- Kim loại kiềm có cấu tạo mạng tinh thể lập phương tâm khối là kiểu mạng không đặc khít (độ đặc khít 68%) nên có khối lượng riêng nhỏ.
- Liên kết trong mạng tinh thể lập phương tâm khối cũng kém bền vững nên kim loại kiềm có nhiệt độ nóng chảy thấp.
- Lớp eletron ngoài cùng chỉ có 1 electron nằm ở phân lớp s (cấu hình ns-1), electron này ở xa hạt nhân nguyên tử nhất nên rất dễ nhường đi ⇒ kim loại kiềm có năng lượng ion hóa thứ nhất I1 nhất.
5. Giải bài 5 trang 153 SGK Hóa 12 nâng cao
Ion Na+ có tồn tại hay không, nếu ta thực hiện các phản ứng hóa học sau:
a. NaOH tác dụng với dung dịch HCl.
b. NaOH tác dụng với dung dịch CuCl2.
c. Phân hủy NaHCO3 bằng nhiệt.
d. Điện phân NaOH nóng chảy.
e. Điện phân dung dịch NaOH.
g. Điện phân NaCl nóng chảy.
Giải thích cho câu trả lời và viết phương trình hóa học minh hoạ.
Phương pháp giải
Để xác định ion Na+ có tồn tại hay không ta dựa vào sản phẩm sau phản ứng xem Na có giữ nguyên số oxi hóa +1 hay không.
Hướng dẫn giải
lon Na+ chỉ bị khử trong phản ứng điện phân nóng chảy (phản ứng d, g) còn trong các phản ứng khác nó vẫn giữ nguyên số oxi hóa +1
Các phương trình hóa học:
a) NaOH + HCl → NaCl + H2O
b) NaOH + CuCl2 → NaCl + Cu(OH)2
c) 2NaHCO3 \(\xrightarrow{{{t^o}}}\) Na2CO3 + H2O + CO2
d) 4NaOH \({\xrightarrow{{dpnc}}}\) 4Na + O2 + 2H2O
e) H2O \(\xrightarrow{{dp{\text{dd}}}}\) 2H2 + O2
g) 2NaCl \({\xrightarrow{{dpnc}}}\) 2Na + Cl2
6. Giải bài 6 trang 153 SGK Hóa 12 nâng cao
Hãy chọn hai kim loại khác, cùng nhóm với kim loại Na và so sánh tính chất của những kim loại này về những mặt sau:
- Độ cứng.
- Khối lượng riêng
- Nhiệt độ nóng chảy.
- Năng lượng ion hóa I1
- Thế điện cực chuẩn EoM+/M.
Phương pháp giải
Để so sánh các kim loại về độ cứng, khối lượng riêng, nhiệt độ nóng chảy, năng lượng ion hóa, thế điện cực chuẩn ta dựa vào bảng số liệu trong sgk.
Hướng dẫn giải
So sánh Na với hai kim loại khác cùng ở nhóm IA:
7. Giải bài 7 trang 153 SGK Hóa 12 nâng cao
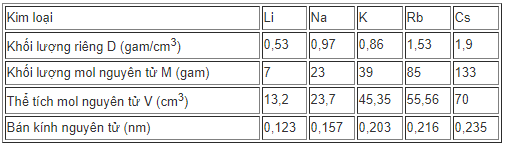
Dựa vào khối lượng riêng của các kim loại kiềm (xem bảng 6.1 trong bài học) để tính thể tích mol nguyên tử của chúng ở trạng thái rắn. Có nhận xét gì về sự biến đổi thể tích mol nguyên tử với sự biến đổi bán kính nguyên tử của các nguyên tố kim loại kiềm?
Phương pháp giải
Để tính thể tích mol nguyên tử ta dựa vào bảng số liệu trong sgk và công thức D = m / V ⇒ V = m / D.
Hướng dẫn giải
Theo công thức D = m / V ⇒ V = m / D
Ta có bảng số liệu sau :
Từ bảng số liệu ta thấy: bán kính và thể tích mol nguyên tử tăng từ Li → Cs theo chiều tăng của điện tích hạt nhân nguyên tử.
Tham khảo thêm
- doc Giải bài tập SGK Hóa 12 Nâng cao Bài 29: Một số hợp chất quan trọng của kim loại kiềm
- doc Giải bài tập SGK Hóa 12 Nâng cao Bài 30: Kim loại kiềm thổ
- doc Giải bài tập SGK Hóa 12 Nâng cao Bài 31: Một số hợp chất quan trọng của kim loại kiềm thổ
- doc Giải bài tập SGK Hóa 12 Nâng cao Bài 32: Luyện tập: Tính chất của kim loại kiềm, kim loại kiềm thổ
- doc Giải bài tập SGK Hóa 12 Nâng cao Bài 33: Nhôm
- doc Giải bài tập SGK Hóa 12 Nâng cao Bài 34: Một số hợp chất quan trong của nhôm
- doc Giải bài tập SGK Hóa 12 Nâng cao Bài 35: Luyện tập: Tính chất của nhôm và hợp chất của nhôm