Giải bài tập SGK Hóa 12 Bài 21: Điều chế kim loại
Nội dung hướng dẫn Giải bài tập Hóa 12 Bài 21 dưới đây sẽ giúp các em học sinh nắm vững phương pháp giải bài tập và ôn luyện tốt kiến thức về điều chế kim loại. Mời các em cùng theo dõi.
Mục lục nội dung

1. Giải bài 1 trang 98 SGK Hóa học 12
Trình bày cách để:
– Điều chế Ca từ CaCO3
– Điều chế Cu từ CuSO4
Viết phương trình hoá học của các phản ứng?
Phương pháp giải
Để điều chế các chất trê cần ghi nhớ:
- Phương pháp điện phân : điện phân nóng chảy muối clorua.
- Cách điều chế Cu:
+ Phương pháp thủy luyện: Dùng kim loại mạnh đẩy Cu ra khỏi dd muối.
+ Phương pháp nhiệt luyện: Dùng CO hoặc H2 khử CuO về Cu.
+ Phương pháp điện phân: Điện phân các muối tan của đồng.
Hướng dẫn giải
- Điều chế Ca từ CaCO3:
Điện phân nóng chảy muối halogenua khan
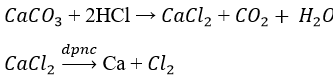
- Điều chế Cu từ CuSO4:
Có thể dùng phương pháp: Điện phân dung dịch, thủy luyện, nhiệt luyện
- Cách 1: Phương pháp thủy luyện : Fe + CuSO4 → FeSO4 + Cu↓
- Cách 2: Phương pháp điện phân dung dịch
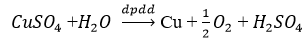
- Cách 3: Nhiệt luyện:
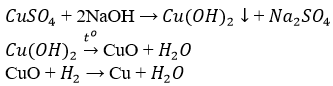
2. Giải bài 2 trang 98 SGK Hóa học 12
Từ Cu(OH)2, MgO, Fe2O3 hãy điều chế các kim loại tương ứng bằng một phương pháp thích hợp. Viết phương trình hóa học của phản ứng?
Phương pháp giải
- Để viết phương trình điều chế Cu,Mg, Fe từ các chất cho ban đầu ta cần ghi nhớ:
+ Điều chế Mg bằng phương pháp điện phân nóng chảy muối clorua.
+ Điều chế Cu, Fe bằng phương pháp thủy luyện, nhiệt luyện hoặc bằng phương pháp điện phân dung dịch.
Hướng dẫn giải
- Điều chế Cu bằng phương pháp nhiệt luyện:
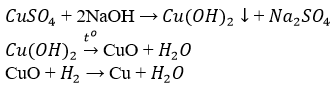
- Điều chế Mg bằng phương pháp điện phân nóng chảy
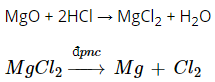
- Điều chế Fe bằng phương pháp nhiệt luyện
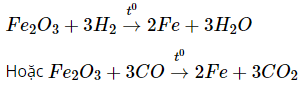
3. Giải bài 3 trang 98 SGK Hóa học 12
Một loại quặng sắt chứa 80% Fe2O3, 10% SiO2 và một số tạp chất khác không chứa Fe và Si. Hàm lượng các nguyên tố Fe và Si trong quặng này là:
A. 56% Fe và 4,7% Si.
B. 54% Fe và 3,7% Si.
C. 53% Fe và 2,7% Si.
D. 52% Fe và 4,7% Si.
Phương pháp giải
Để xác định hàm lượng các nguyên tố Fe và Si, ta thực hiện các bước sau:
- Bước 1: Giả sử có 100 gam quặng sắt thì khối lượng Fe2O3 là 80 gam và khối lượng SiO2 là 10 gam.
- Bước 2: Tính được nFe2O3 => nFe = ? => mFe = ?
- Bước 3: Tính được nSiO2 => nSi = ? => mSi = ?
- Bước 4: Áp dụng công thức tính thành phần phần trăm
%Fe = (mFe/ mquặng).100%
%Si = (mSi /mquặng).100%
Hướng dẫn giải
Giả sử có 100 gam quặng sắt thì khối lượng Fe2O3 là 80 gam và khối lượng SiO2 là 10 gam
Số mol Fe2O3 là nFe2O3 = 80 / 160 = 0,5(mol)
Áp dụng bảo toàn nguyên tố Fe ta có:
nFe = 2 x nFe2O3 = 0,5.2 = 1(mol)
Suy ra khối lượng của sắt là mFe = 1.56 = 56(g)
Phần trăm khối lượng Fe trong 100g quặng sắt:
%mFe = (56.100)/100 = 56%
Tương tự tính cho Si:
nSi = nSiO2 = 10/60 = 1/6 (mol)
→ mSi = 28.1/6 =14/3 (gam)
%Si =(14/3.100)/100 = 4,7%
Vậy hàm lượng các nguyên tố Fe và Si trong quặng này là 56% Fe và 4,7% Si
→ Đáp án A.
4. Giải bài 4 trang 98 SGK Hóa học 12
Để khử hoàn toàn 30 gam hỗn hợp gồm CuO, FeO, Fe3O4, Fe2O3, Fe, MgO cần dùng 5,6 lít khí CO (đktc). Khối lượng chất rắn thu được sau phản ứng là:
A. 28 gam.
B. 26 gam.
C. 24 gam.
D. 22 gam.
Phương pháp giải
Để tính khối lượng chất rắn thu được sau phản ứng, ta thực hiên các bước sau:
- Bước 1: Gọi công thức tổng quát của các oxit là RxOy
- Bước 2: Viết phương trình hóa học:
RxOy + yCO \(\xrightarrow{{{t^o}}}\) xR + yCO2
- Bước 3: Từ PTHH trên => nCO2 = nCO => mCO2 =?
- Bước 4: Áp dụng định luật bảo toàn khối lượng ta có:
mOxit + mCO = mR + mCO2
=> mR =?
Hướng dẫn giải
PTHH tổng quát: RxOy + yCO → xR + yCO2
Từ phương trình trên:
⇒ nCO2 = nCO = \(\frac{5,6}{22,4}\) = 0,25 (mol)
Áp dụng định luật bảo toàn khối lượng, ta có:
mhỗn hợp oxit + mCO → mchất rắn + mCO2
⇒ mchất rắn = 30 + 0,25.44 – 0,25.28 = 26 (gam).
Vậy đáp án cần chọn là B.
5. Giải bài 5 trang 98 SGK Hóa học 12
Điện phân (điện cực trơ) dung dịch muối sunfat của một kim loại hoá trị II với dòng điện cường độ 3A. Sau 1930 giây điện phân thấy khối lượng catot tăng 1,92 gam.
a) Viết phương trình hoá học của phản ứng xảy ra tại mỗi điện cực và phương trình hoá học của sự điện phân.
b) Xác định tên kim loại.
Phương pháp giải
Đây là dạng bài tập điện phân, ta cần ghi nhớ:
a) Viết các bán phản ứng xảy ra các điện cực:
Tại catot (-): M2+ + 2e → M
Tại anot (+): 2H2O → 4H+ + O2 + 4e
PTHH phản ứng điện phân: 2MSO4 + 2H2O \(\xrightarrow{{dpnc}}\) 2M +O2 + 2H2SO4
b) Áp dụng công thức:
m = AIt/n.F => A =? => kim loại
Hướng dẫn giải
Câu a
- Catot: M2+ + 2e → M
- Anot: 2H2O → 4H+ + O2 + 4e
PTHH của phản ứng điện phân:
2MSO4 + 2H2O → 2M +O2 + 2H2SO4
Câu b
Áp dụng định luật Faraday ta có:
\(\ m = \frac{Alt}{n.F} \Rightarrow A = \frac{2.96500.1,92}{3.1930} = 64\)
⇒ Kim loại Cu.
Tham khảo thêm
- doc Giải bài tập SGK Hóa 12 Bài 17: Vị trí của KL trong bảng tuần hoàn và cấu tạo của KL
- doc Giải bài tập SGK Hóa 12 Bài 18: Tính chất của kim loại. Dãy điện hóa của kim loại
- doc Giải bài tập SGK Hóa 12 Bài 19: Hợp kim
- doc Giải bài tập SGK Hóa 12 Bài 20: Sự ăn mòn kim loại
- doc Giải bài tập SGK Hóa 12 Bài 22: Luyện tập tính chất của kim loại
- doc Giải bài tập SGK Hóa 12 Bài 23: Luyện tập: Điều chế kim loại và sự ăn mòn kim loại



