Giải bài tập SGK Hóa 11 Nâng cao Bài 44: Luyện tập hiđrocacbon không no
Dưới đây là Hướng dẫn giải Hóa 11 SGK nâng cao Chương 6 Bài 44 Luyện tập hiđrocacbon không no được eLib biên soạn và tổng hợp, nội dung bám sát theo chương trình SGK Hóa học 11 nâng cao giúp các em học sinh nắm vững phương pháp giải bài tập và ôn tập kiến thức hiệu quả hơn.
Mục lục nội dung
1. Giải bài 1 trang 181 SGK Hóa học 11 nâng cao
2. Giải bài 2 trang 181 SGK Hóa học 11 nâng cao
3. Giải bài 3 trang 181 SGK Hóa học 11 nâng cao
4. Giải bài 4 trang 182 SGK Hóa học 11 nâng cao
5. Giải bài 5 trang 182 SGK Hóa học 11 nâng cao
6. Giải bài 6 trang 182 SGK Hóa học 11 nâng cao
7. Giải bài 7 trang 182 SGK Hóa học 11 nâng cao

Giải bài tập SGK Hóa 11 Nâng cao Bài 44: Luyện tập hiđrocacbon không no
1. Giải bài 1 trang 181 SGK Hóa 11 nâng cao
a) Điền các số thích hợp vào bảng.
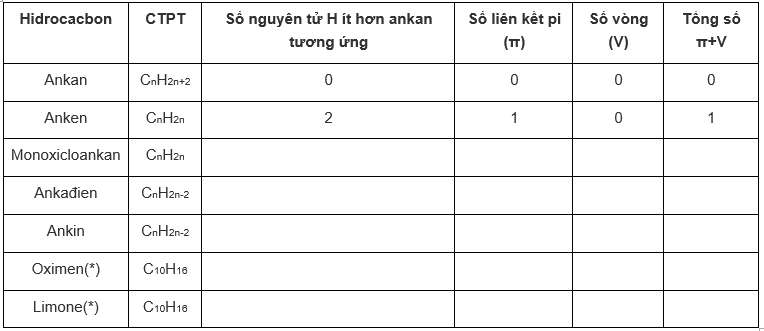
(*) công thức cấu tạo cho ở Giải bài “khái niệm về tecpen”.
(**) dùng kí hiệu (π+v) trong các Giải bài tập sẽ có lợi và gọn.
b) Hãy cho biết số lượng nguyên tử H ở phân tử xicloankan và ở phân tử mỗi loại hidrocacbon không no ít hơn ở phân tử ankan tương ứng là bao nhiêu, giải thích vì sao lại ít hơn ngần ấy.
Phương pháp giải
Số liên kết của hợp chất hữu cơ mạch hở A, công thức Hy hoặc HyOz dựa vào mối liên quan giữa số mol 2; O thu được khi đốt cháy A được tính theo công thức sau:
A là Hy hoặc HyOz mạch hở, cháy cho − nH2O = k.nA thì A có số k+1
Lưu ý: Hợp chất HyOzNtClu có số = (2x − y − u + t + 2) : 2
Hướng dẫn giải
Câu a:
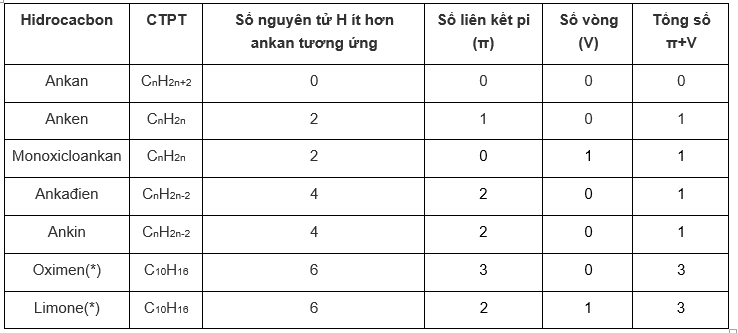
Câu b:
1 nguyên tử C có 4 electron hóa trị
⇒ n nguyên tử C có 4.n electron hóa trị.
⇒ số liên kết σ giữa các nguyên tử C trong phân tử ankan (n-1).
⇒ số c hóa trị dùng tạo (n - 1) liên kết σ giữa C-C là (n-1).2.
⇒ số nguyên tử H là 2n + 2. Công thức ankan : CnH2n+2
Với các hidrocacbon không no hay vòng. Số e hóa trị phải dùng cho 1 liên kết π là 2: 1 vòng tương ứng với 1 liên kết π, một nối ba tương ứng với hai nối đôi.
Như vậy:
Số H trong phân tử anken hoặc xicloankan kém hơn anka có số C tương ứng là 2 vì anken có 1 liên kết π và xicloankan có một vòng.
Số H trong phân tử ankin hoặc ankadien kém hơn ankan có số C tương ứng là 4 vì ankin có một nối ba và ankadien ó hai nối đôi.
2. Giải bài 2 trang 181 SGK Hóa 11 nâng cao
Hãy điền các từ hoăc các số cho dưới đây vào chỗ trống trong các câu sau:
a) anken và…(1)…đều có (π+v) =1; nhưng…(2)… có (v) = 1 còn …(3)… có (v) =…(4)…
b) …(5)… và …(6)… đều có (π+v)=2; chúng đều có π=…(7)… và (v) =…(8)…
A. ankin
B. 1
C. xicloankan
D. 2;
E. anken
G. ankađien
H. 2
K. 0.
Phương pháp giải
Dựa vào cách xác định số liên kết π để giải bài tập
Hướng dẫn giải
Câu a:
(1) xicloankan
(2) xicloankan
(3) anken
(4) 0.
Câu b:
(5) ankadien
(6) ankin
(7) 2
(8). 0.
3. Giải bài 3 trang 181 SGK Hóa 11 nâng cao
a) Meton (mùi bạc hà) có công thức phân tử C10H18O chỉ chứa 1 liên kết đôi. Hỏi nó có cấu tạo mạch vòng hay hở?
b) Vitamin A có công thức phân tử C10H30O có chứa 1 vòng 6 cạnh không chứa liên kết ba. Hỏi trong phân tử có mấy liên kết đôi?
Phương pháp giải
Từ công thức tính số liên kết π → Xác định số vòng
Hướng dẫn giải
Câu a: Menton C10H18O có:
(π+v)=2.10+2−182=2
C10H18O chỉ chứa 1 liên kết đôi
⇒ π=1 ⇒ phân tử chứa 1 vòng
⇒ Meton có cấu tạo mạch vòng.
Câu b: Vitamin C10H30O có:
(π+v)=2.10+2−302=6
C10H30O có 1 vòng ⇒ số π=5
Phân tử không có liên kết 3 nên Vitamin A có 5 liên kết đôi.
4. Giải bài 4 trang 182 SGK Hóa 11 nâng cao
a) Hãy viết công thức cấu tạo chung của anken, ankadien, ankin và nêu đặc điểm trong cấu trúc không gian của chúng.
b) Hãy cho biết những nhóm nguyên tử nào quyết định đặc tính hóa học của anken, ankadien, ankin. Vì sao?
c) Hãy kể những phản ứng đặc trưng của anken, anka-1,3-đien và ankin.
Phương pháp giải
Nắm vững tính chất vật lí, hóa học và đặc điểm trong cấu trúc không gian của anken, ankadien, ankin
Hướng dẫn giải
Câu a:
- Công thức cấu tạo chung của anken R1R2C=CR3R4
- Công thức cấu tạo chung của ankadien: R1R2C=CH-(CH2)n-CH=CR3R4 (n∈N).
- Công thức cấu tạo chung của ankin R1C≡CR2
Với anken và ankadien có thể có cấu trúc không gian.
Câu b: Nối đôi C=C quyết định tính chất hóa học của anken và ankadien; nối ba C≡C quyết định tính chất hóa học của ankin.
Câu c: Phản ứng đặc trưng của anken là phản ứng công, của anka-1,3-dien là cộng, của ankin là cộng và thế.
5. Giải bài 5 trang 182 SGK Hóa 11 nâng cao
a) Hãy nêu những nguyên tắc chung điều chế anken, ankađien, ankin để dùng trong công nghiệp tổng hợp hữu cơ. Lấy thí dụ điều chế chất tiêu biểu cho mỗi loại.
b) Vì sao etilen là hóa chất hữu cơ được sản xuất với sản lượng lớn nhất?
Phương pháp giải
- Nguyên tắc chung điều chế anken, ankadien, ankin là tách H2 ra khỏi ankan
- Eilen là ngày nay được dùng làm nguyên liệu quan trọng trong sản xuất polime và nhiều hóa chất cơ bản khác nên được sản xuất với sản lượng lớn
Hướng dẫn giải
Câu a: Nguyên tắc chung điều chế anken, ankadien, ankin là tách H2 ra khỏi ankan
CH3-CH3 → CH2=CH2 + H2 (xt, to)
CH3-CH2-CH2-CH3 → CH2=CH-CH=CH2 + 2H2 (xt, to)
2CH4 → C2H2 + 3H2 (làm lạnh nhanh)
Câu b: Etilen là ngày nay được dùng làm nguyên liệu quan trọng trong sản xuất polime và nhiều hóa chất cơ bản khác nên được sản xuất với sản lượng lớn.
6. Giải bài 6 trang 182 SGK Hóa 11 nâng cao
Dùng công thức cấu tạo hãy viết các phương trình hóa học của phản ứng theo sơ đồ sau:
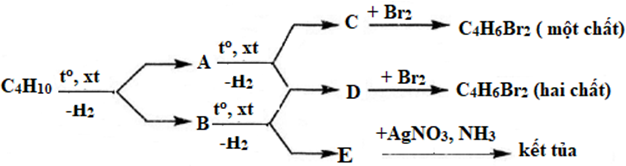
Phương pháp giải
Dựa vào tính chất hoá học của hidrocabon không no để viết phuong trình phản ứng.
Hướng dẫn giải
CH3-CH2-CH2-CH3 → CH3-CH=CH-CH3 (A) + H2 (xt, to)
CH3-CH2-CH2-CH3 → CH2=CH-CH2-CH3 (B) + H2 (xt, to)
CH3-CH2-CH2-CH3 → CH3-C≡C-CH3 (C) + H2 (xt, to)
CH3-CH2-CH2-CH3 → CH2=CH-CH=CH2 (D) + H2 (xt, to)
CH2=CH-CH2-CH3 → CH2=CH-CH=CH2 (D) + H2 (xt, to)
CH2=CH-CH2-CH3 → CH≡C-CH2CH3 (E) + H2 (xt, to)
CH3-C≡C-CH3 + Br2 → CH3-CBr=CBr-CH3
CH2=CH-CH=CH2 + Br2 → CH2Br-CHBr-CH=CH2 (tỉ lệ 1:2)
CH2=CH-CH=CH2 + Br2 → CH2Br-CH=CH-CH2Br (tỉ lệ 1:4)
CH≡C-CH2CH3 + [Ag(NH3)2](OH) → AgC≡C-C2H5 + 2NH3 + H2O
Vậy A là: CH3-CH=CH-CH3
B là CH3-CH2-CH=CH2
C là CH3-C≡C-CH3
D là CH2=CH-CH=CH2 và E là CH≡C-C2H5
7. Giải bài 7 trang 182 SGK Hóa 11 nâng cao
Khi đốt cháy hoàn toàn một hidrocacbon ở thể khí (điều kiện thường) thì thấy thể tích các khí tạo thành sau phản ứng đúng bằng thể tích các khí tham gia phản ứng (ở cùng điều kiện nhiệt độ và áp suất). Hãy cho biết hidrocacbon đó có thể nhận các công thức phân tử như thế nào?
Phương pháp giải
CxHy+(x+y4)O2→xCO2+y2H2O
Theo đề bài ta có:
1+x+y4=x+y2 → y = ?
→ Công thức phân tử của hidrocacbon
Hướng dẫn giải
Hidrocacbon khí ở điều kiện thường nên 1 ≤ x ≤ 4 và 0 ≤ y ≤ 2x+2
Xét 1 mol CxHy
CxHy+(x+y4)O2→xCO2+y2H2O
Theo đề bài ta có:
1+x+y4=x+y2 → y = 4
Công thức phân tử của hidrocacbon có thể là CH4, C2H4, C3H4, C4H4.
8. Giải bài 8 trang 182 SGK Hóa 11 nâng cao
Hỗn hợp A gồm hai chất kế tiếp nhau trong dãy đồng đẳng của etilen. Cho 3,36 lít (đktc) hỗn hợp khí trên phản ứng hoàn toàn với Br2 trong CCl4 thì thấy khối lượng bình chứa nước brom tăng thêm 7,7 gam.
a) Hãy xác định công thức phân tử của hai anken đó.
b) Xác định thành phần phần trăm về thể tích của hỗn hợp A.
c) Viết công thức cấu tạo của các anken đồng phân có cùng công thức phân tử với hai anken đã cho.
Phương pháp giải
Công thức chung của hai anken: Cn−H2n− (a mol).
nA = ? → nA.14n = 7,7 → Tìm khoảng biến thiên
→ Công thức phân tử của hai anken
{x+y=anx+myx+y=¯n→{x+y=0,153x+4yx+y=113→{x=0,05y=0,1
→ Phần trăm thể tích mỗi anken
Hướng dẫn giải
Câu a: Đặt công thức tổng quát của anken thứ nhất là CnH2n (x mol), công thức tổng quát của anken thứ hai là CmH2m (y mol)
⇒ Công thức chung của hai anken: Cn−H2n− (a mol).
Số mol hỗn hợp A là 3,36/22,4 = 0,15 mol
Theo đề Giải bài ta có: 0,15.14n− = 7,7
⇒ n = 3 < n− = 3,67 = 11/3 < m = 4
Công thức phân tử của hai anken là C3H6 và C4H8.
Câu b: Ta có:
{x+y=anx+myx+y=¯n→{x+y=0,153x+4yx+y=113→{x=0,05y=0,1
Phần trăm thể tích mỗi anken là:
%V=0,05.100%0,15=33,33%%V=100−33,33%=66,67%
Câu c: Công thức cấu tạo của C3H6: CH3-CH=CH2 : Propen
Công thức cấu tạo của C4H8:
CH3-CH2-CH=CH2: but-1-en
CH2=C(CH3)-CH3: 2-metyl propen
CH3-CH=CH-CH3: but-2-en
But–2-en có đồng phân hình học cis và trans
9. Giải bài 9 trang 182 SGK Hóa 11 nâng cao
Nhiệt phân 2,8 lít (đktc) etan ở 1200oC rồi cho một nửa hỗn hợp khí thu được sục qua bình đựng nước brom (dư) thì thấy khối lượng này tăng thêm 1,465 gam. Cho nửa hỗn hợp khí còn lại phản ứng với dung dịch AgNO3 trong ammoniac thì thu được 0,6 gam kết tủa màu vàng. Biết rằng phản ứng nhiệt phân tạo ra etilen, axetilen là phản ứng không hoàn toàn, các phản ứng tiếp sau đó đều xảy ra hoàn toàn. Hãy xác định thành phần phần trăm về thể tích của hỗn hợp khí thu được.
Phương pháp giải
nC2H6 = ?
C2H6 → C2H4 + H2 (1)
C2H6 → C2H3 + 2H2 (2)
Hỗn hợp sau phản ứng: C2H4 2x mol; C2H2 2y mol; H2 (2x+4y) mol; C2H6 dư |0,125-(2x+2y)| mol
Ta có mC2H4 + mC2H2 = mbình tăng
CH≡CH + 2[Ag(NH3)2]OH → AgC≡CAg + 4NH3 + 2H2O (3)
Từ (3) ⇒ y = ?
Hỗn hợp sau phản ứng:
C2H4 0,1 mol; C2H2 0,005 mol; H2 0,11 mol; C2H6 dư 0,02 mol
⇒ Số mol hỗn hợp sau phản ứng ?
⇒ Phần phần trăm thể tích các khí trong hỗn hợp sau phản ứng.
Hướng dẫn giải
Số mol C2H6 ban đầu: 2,8/22,4 = 0,125 mol.
Đặt số mol C2H6 tham gia phản ứng (1), (2) lần lượt là 2x mol và 2y mol
C2H6 → C2H4 + H2 (1)
2x 2x 2x
C2H6 → C2H3 + 2H2 (2)
2 2y 4y
Hỗn hợp sau phản ứng: C2H4 2x mol; C2H2 2y mol; H2 (2x+4y) mol; C2H6 dư |0,125-(2x+2y)| mol
C2H4 + Br2 → C2H4Br2;
C2H2 + 2Br2 → C2H2Br4
Ta có mC2H4 + mC2H2 = mbình tăng ⇒ 28x + 26y = 1,465 (*)
CH≡CH + 2[Ag(NH3)2]OH → AgC≡CAg + 4NH3 + 2H2O (3)
y y
Từ (3) ⇒ y = 0,6/240 (**)
Giải hệ (*) và (**) ta được x = 0,05, y = 0,0025
Hỗn hợp sau phản ứng:
C2H4 0,1 mol; C2H2 0,005 mol; H2 0,11 mol; C2H6 dư 0,02 mol
Số mol hỗn hợp sau phản ứng : 0,1+ 0,005 + 0,11 + 0,02 = 0,235 mol
Thành phần phần trăm thể tích các khí trong hỗn hợp sau phản ứng:
%VC2H4=0,1.100%0,235=42,55%%VC2H2=0,005.100%0,235=2,13%%VH2=(0,1+0,005.2).100%0,235=46,80%%VC2H6=0,02.100%0,235=8,51%
Tham khảo thêm
- doc Giải bài tập SGK Hóa 11 Nâng cao Bài 39: Anken - Danh pháp, cấu trúc và đồng phân
- doc Giải bài tập SGK Hóa 11 Nâng cao Bài 40: Anken - Tính chất, điều chế và ứng dụng
- doc Giải bài tập SGK Hóa 11 Nâng cao Bài 41: Ankađien
- doc Giải bài tập SGK Hóa 11 Nâng cao Bài 42: Khái niệm về tecpen
- doc Giải bài tập SGK Hóa 11 Nâng cao Bài 43: Ankin




