Giải bài tập SGK Hóa 11 Nâng cao Bài 27: Phân tích nguyên tố
Trên đây là nội dung chi tiết Giải bài tập nâng cao Hóa 11 Chương 4 Phân tích nguyên tố, với hướng dẫn giải chi tiết, rõ ràng, trình bày khoa học. eLib hy vọng đây sẽ là tài liệu hữu ích giúp các bạn học sinh lớp 11 học tập thật tốt!
Mục lục nội dung

1. Giải bài 1 trang 113 SGK Hóa 11 nâng cao
Phân tích định tính và định lượng C, H trong hợp chất hữu cơ giống nhau khác nhau như thế nào?
Phương pháp giải
- Phân tích định tính: Xác định sự có mặt của C và H qua sản phẩm CO2 và H2O
- Phân tích định lượng: Xác định hàm lượng của C và H qua sản phẩm CO2 và H2O.
Hướng dẫn giải
* Giống nhau: Chuyển hợp chất hữu cơ thành hợp chất hữu cơ đơn giản.
* Khác nhau:
- Phân tích định tính: Xác định sự có mặt của C và H qua sản phẩm CO2 và H2O
- Phân tích định lượng: Xác định hàm lượng của C và H qua sản phẩm CO2 và H2O.
2. Giải bài 2 trang 113 SGK Hóa 11 nâng cao
Em hãy đề nghị:
a) Cách nhận biết H2O, CO2 khác với ở hình 4.5
b) Cách định tính halogen khác với ở hình 4.6
c) Chất hấp thụ định lượng H2O và CO2
Phương pháp giải
Quan sát hai thí nghiệm sau để trả lời câu hỏi
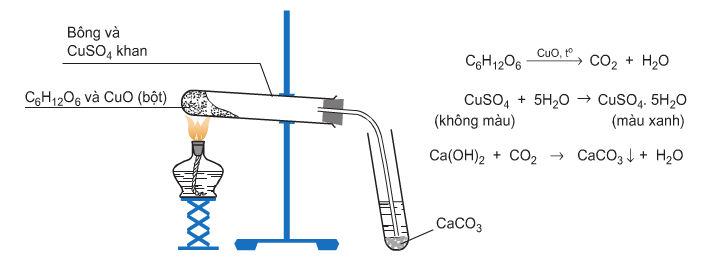
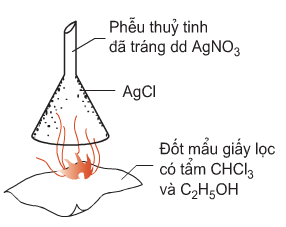
Hướng dẫn giải
Câu a:
- Nhận biết H2O: Phương pháp định lượng: dùng bình chứa P2O5 với khối lượng biết trước, hấp thụ sản phẩm cháy rồi cân lại, khối lượng bình chứa P2O5 tăng lên chính bằng khối lượng H2O.
Hoặc làm lạnh sản phẩm cháy sẽ thấy hơi nước ngưng tụ.
- Nhận biết CO2: Dẫn sản phẩm cháy qua ống nghiệm chứa dung dịch Ba(OH)2, thấy xuất hiện kết tủa trắng chứng tỏ có CO2.
CO2 + Ba(OH)2 → BaCO3↓ + H2O
Câu b: Nhận biết halogen: Phân hủy hợp chất hữu cơ để chuyển halogen thành HX, sau đó dùng dung dịch Pb(NO3)2 để nhận biết HX, thấy xuất hiện kết tủa trắng AgX (X = Cl, Br)
Pb(NO3)2 + 2HX → PbX2 + HNO3
Câu c: Sử dụng chất hấp thụ định lượng H2O và CO2 là: P2O5 và KOH
- Dẫn sản phẩm cháy qua bình chứa P2O5, khối lượng bình chứa P2O5 tăng lên chính là khối lượng H2O.
- Dẫn phần còn lại qua bình chứa KOH, khối lượng bình tăng lên chính là khối lượng CO2.
3. Giải bài 3 trang 113 SGK Hóa 11 nâng cao
a) Để nhận biết khí ammoniac sinh ra khi định tính nitơ như trình bày trong bài học nên ta dùng cách nào sau đây?
A. Ngửi
B. Dùng Ag2O
C. Dùng giấy quỳ tím tẩm ướt
D. Dùng phenolphthalein.
b) Dấu hiệu nào dưới đây khẳng định kết tủa bám trên thành phễu ở hình 4.6 là AgCl.
A. Đốt không cháy
B. Không tan trong nước.
C. Không tan trong dung dịch H2SO4
D. Không tan trong dung dịch HNO3
Phương pháp giải
Quan sát các hình vẽ, giải thích

Hướng dẫn giải
Câu a: Để nhận biết khí amoniac sinh ra khi định tính nitơ người ta dùng giấy quỳ tím tẩm ướt.
Câu b: Dấu hiệu khẳng định kết tủa bám trên thành phễu ở hình 4.6 là AgCl không tan trong dung dịch HNO3.
HCl + AgNO3 → AgCl↓ + HNO3
4. Giải bài 4 trang 113 SGK Hóa 11 nâng cao
Nếu lấy một sợi dây gạt bỏ vỏ nhựa rồi đốt lõi đồng trên ngọn lửa đèn cồn thì thấy ngọn lửa nhuộm màu xanh lá mạ, sau đó ngọn lửa mất màu xanh. Nếu áp lõi dây đồng đang nóng vào dây điện rồi đốt thì thấy ngọn lửa lại nhuộm màu xanh lá mạ. Hãy dự đoán nguyên nhân của hiện tượng và giải thích.
Phương pháp giải
Dựa vào khả năng phản ứng của Cu, PVC để giải thích hiện tượng
Hướng dẫn giải
Màu xanh lá mạ là so CuCl2 phân tán vào ngọn lửa. sự hình thành CuCl2 được giải thích như sau:
- PVC cháy tạo HCl
- Cu bị đốt sinh ra CuO
- Tương tác giữa HCl và CuO tạo ra CuCl2: CuO + 2HCl → CuCl2 + H2O
Tuy nhiên ở đây dây đồng đã gọt bỏ vỏ nhựa rồi đốt lõi trên ngọn lửa đèn cồn PVC có còn đâu mà cháy tạo ra HCl.
5. Giải bài 5 trang 114 SGK Hóa 11 nâng cao
Oxi hóa hoàn toàn 4,92 mg một hợp chất A chứa C, H, N và O rồi cho sản phẩm lần lượt qua bình chứa H2SO4 đậm đặc, bình chứa KOH thì thấy khối lượng bình chứa H2SO4 tăng thêm 1,81 mg, bình chứa KOH cũng tăng thêm 10,56 mg. Hãy xác định hàm lượng phần trăm của C, H, N, O ở hợp chất A.
Phương pháp giải
- Khối lượng bình đựng H2SO4 tăng chính bằng khối lượng H2O
- Khối lượng bình đựng KOH tăng chính bằng khối lượng CO2
→ %mC, %mH, %mN, %O
Hướng dẫn giải
- Khối lượng bình đựng H2SO4 tăng chính bằng khối lượng H2O ⇒ mH2O = 1,81.10-3 (gam)
- Khối lượng bình đựng KOH tăng chính bằng khối lượng CO2 ⇒ mCO2 = 10,56.10-3 (gam)
\(\begin{array}{l}
\% {m_C} = \frac{{10,{{56.10}^{ - 3}}.12.100\% }}{{44.4,{{92.10}^{ - 3}}}} = 58,54\% \\
\% {m_H} = \frac{{1,{{81.10}^{ - 3}}.2.100\% }}{{4,{{92.10}^{ - 3}}.18}} = 4,09\% \\
\% {m_N} = \frac{{28.0,{{55.10}^{ - 3}}.100\% }}{{22.4.6,{{15.10}^{ - 3}}}} = 11,18\% \\
\% {m_O} = 100\% - (58,54 + 4,09 + 11,18) = 26,19\%
\end{array}\)
Tham khảo thêm
- doc Giải bài tập SGK Hóa 11 Nâng cao Bài 25: Hóa học hữu cơ và hợp chất hữu cơ
- doc Giải bài tập SGK Hóa 11 Nâng cao Bài 26: Phân loại và gọi tên hợp chất hữu cơ
- doc Giải bài tập SGK Hóa 11 Nâng cao Bài 28: Công thức phân tử hợp chất hữu cơ
- doc Giải bài tập SGK Hóa 11 Nâng cao Bài 29: Luyện tập chất hữu cơ, công thức phân tử
- doc Giải bài tập SGK Hóa 11 Nâng cao Bài 30: Cấu trúc phân từ hợp chất hữu cơ
- doc Giải bài tập SGK Hóa 11 Nâng cao Bài 31: Phản ứng hữu cơ
- doc Giải bài tập SGK Hóa 11 Nâng cao Bài 32: Luyện tập cấu trúc phân tử hợp chất hữu cơ



