Giải bài tập SGK Hóa 11 Bài 35: Benzen và đồng đẳng. Một số hiđrocacbon thơm khác
Mời các em học sinh cùng tham khảo nội dung giải bài 35 SGK Hóa học 11 dưới đây. Tài liệu được biên soạn và tổng hợp với nội dung đầy đủ, chi tiết, hy vọng đây sẽ là tài liệu hữu ích giúp các em học tập thật tốt.
Mục lục nội dung
1. Giải bài 1 trang 159 SGK Hóa học 11
2. Giải bài 2 trang 159 SGK Hóa học 11
3. Giải bài 3 trang 159 SGK Hóa học 11
4. Giải bài 4 trang 160 SGK Hóa học 11
5. Giải bài 5 trang 160 SGK Hóa học 11
6. Giải bài 6 trang 160 SGK Hóa học 11
7. Giải bài 7 trang 160 SGK Hóa học 11
8. Giải bài 8 trang 160 SGK Hóa học 11
9. Giải bài 9 trang 160 SGK Hóa học 11
10. Giải bài 10 trang 160 SGK Hóa học 11
11. Giải bài 11 trang 160 SGK Hóa học 11

Giải bài tập SGK Hóa 11 Bài 35: Benzen và đồng đẳng. Một số hiđrocacbon thơm khác
1. Giải bài 1 trang 159 SGK Hóa học 11
Ứng với công thức phân tử C10H8 có bao nhiêu đồng phân hiđrocacbon thơm?
A. 2.
B. 3.
C. 4.
D. 5.
Phương pháp giải
Bước 1: vẽ vòng thơm → dư bao nhiêu C sẽ để lại làm mạch nhánh
Bước 2: Vẽ nhánh ( chú ý các vị trí o, m, p) để các công thức không bị trùng nhau.
Hướng dẫn giải
Ứng với công thức phân tử C8H10 có 4 đồng phân hiđrocacbon thơm:
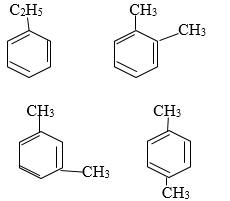
2. Giải bài 2 trang 159 SGK Hóa học 11
Toluen và benzen cùng phản ứng được với chất nào sau đây: (1) dung dịch brom trong CCl4; (2) dung dịch kali pemanganat; (3) hiđro có xúc tác Ni, đun nóng; (4) Br2 có bột Fe, đun nóng? Viết phương trình phản ứng hóa học của các phản ứng xảy ra.
Phương pháp giải
Toluen và benzen cùng phản ứng hiđro có xúc tác Ni và Br2 có bột Fe → Viết PTHH của phản ứng
Hướng dẫn giải
Toluen và benzen cùng phản ứng hiđro có xúc tác Ni và Br2 có bột Fe, đun nóng theo các phương trình hóa học sau:
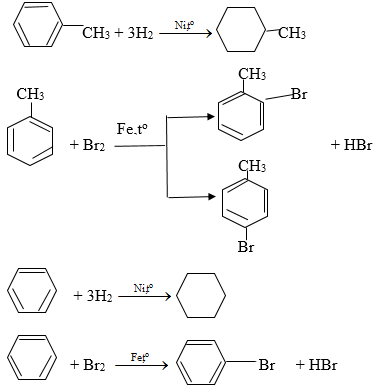
3. Giải bài 3 trang 159 SGK Hóa học 11
Viết phương trình hóa học của các phản ứng xảy ra trong mỗi trường hợp sau:
a) Toluen tác dụng với hiđro có xúc tác Ni, áp suất cao, đun nóng.
b) Đun nóng benzen với hỗn hợp HNO3 đặc và H2SO4 đặc
Phương pháp giải
Xem lại lý thuyết về benzen và các ankylbenzen
Hướng dẫn giải
Câu a: Phương trình hóa học toluen tác dụng với hiđro có xúc tác Ni, áp suất cao, đun nóng
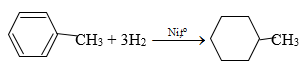
Câu b: Phương trình hóa học đun nóng benzen với hỗn hợp HNO3 và H2SO4 đặc
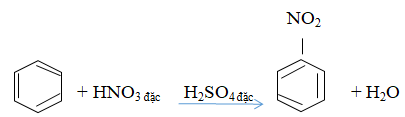
4. Giải bài 4 trang 160 SGK Hóa học 11
Trình bày phương pháp hóa học phân biệt các chất: benzen, hex – 1 – en và toluen. Viết phương trình hóa học của các phản ứng đã dùng.
Phương pháp giải
Ta thấy benzen khó tham gia phản ứng cộng, chỉ cộng H2
Hex - 1 -en thuộc dãy anken → dễ tham gia phản ứng cộng Br2, H2, thuốc tím
toluen có tính chất tương tự như benzen nhưng có thêm khả năng làm mất màu dd thuốc tím khi đun nóng
→ Chọn ra các tính chất hóa học khác nhau để chọn thuốc thử phân biệt được chúng.
Hướng dẫn giải
Trích mỗi chất 1 ít cho ra các ống nghiệm khác nhau và đánh số thứ tự tương ứng
- Nhỏ lần lượt dd brom vào 3 ống nghiệm trên: ống nghiệm nào dd brom nhạt màu là hex – 1 – en. 2 ống còn lại không có hiện tượng là benzen, toluen.
CH2=CH-[CH2]3-CH3 + Br2 (dd màu nâu đỏ) → CH2Br -CHBr -[CH2]3-CH3 ( dd không màu)
-Nhỏ dung dịch KMnO4 vào hai ống nghiệm còn lại và đun nóng, ống nghiệm nào có hiện tượng mất màu là toluen. Chất còn lại không có hiện tượng gì là benzen
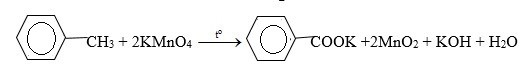
5. Giải bài 5 trang 160 SGK Hóa học 11
Hiđrocacbon X là chất lỏng có tỉ khối hơi so với không khí bằng 3,17. Đốt cháy hoàn toàn X thu được CO2 có khối lượng bằng 4,28 lần khối lượng H2O. Ở nhiệt độ thường, X không làm mất màu dung dịch brom. Khi đun nóng, X làm mất màu dung dịch KMnO4.
a) Tìm công thức phân tử và viết công thức cấu tạo của X.
b) Viết phương trình hóa học của phản ứng giữa X và H2 (xúc tác Ni, đun nóng), với brom (có mặt Fe), với hỗn hợp dư của axit HNO3 và axit H2SO4 đậm đặc.
Phương pháp giải
a) Gọi CTPT của X là CxHy
MX = 3,17.29 = 92
→ 12x + y = 92 (1)
CxHy+(x+y4)O2→xCO2+y2H2Ox(mol)→0,5y(mol)→mCO2mH2O=44x0,5y.18=4,28→y=1,14x(2)
Từ (1) và (2) → x = ? và y = ?
→ CTPT của X là ? → CTCT X =?
b) X + H2 (Ni, t0) → phản ứng cộng phá vỡ liên kết I trong vòng benzen
X + Br2 ( bột Fe)→ phản ứng thế vào vòng benzen vị trí o, p
X + HNO3 đặc ( xt H2SO4 đặc) → phản ứng thế vào vòng benzen vị trí o, p
Hướng dẫn giải
Câu a: Gọi công thức phân tử của X là CxHy:
CxHy + (x + y)/4 O2 → xCO2 + y/2H2O
Ta có:
MX = 3,17. 29 = 92 ⇒ 12x + y = 92 (1)
mCO2 = 4,28mH2O ⇒ 44x = 4,28. 18. (y/2) ⇒ y = 1,14x (2)
Từ (1) và (2) ⇒ x = 7, y = 8. Công thức phân tử của X là C7H8
Từ đề bài ⇒ Công thức cấu tạo của X là: C6H5CH3
Câu b:
Phương trình hoá học của phản ứng giữa X với H2 (xúc tác Ni, đun nóng)
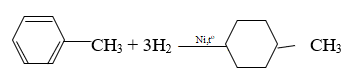
Phương trình hoá học của phản ứng giữa X với brom (có mặt bột Fe)
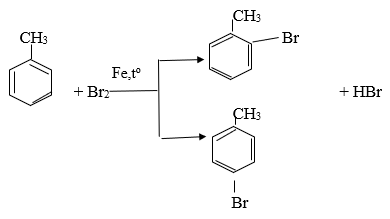
Phương trình hoá học của phản ứng giữa X với hỗn hợp dư của axit HNO3 và axit H2SO4 đậm đặc
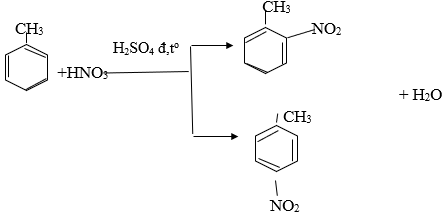
6. Giải bài 6 trang 160 SGK Hóa học 11
Đánh dấu (+) vào ô cặp chất phản ứng với nhau theo mẫu sau:
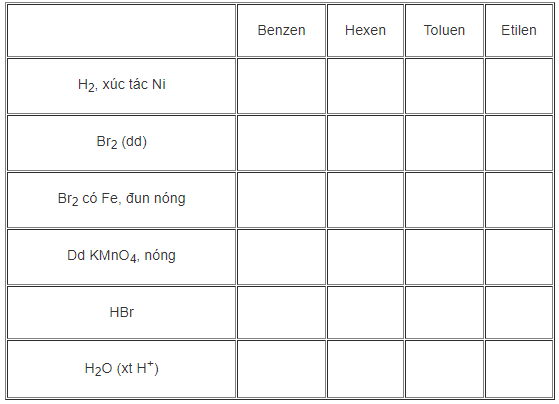
Phương pháp giải
Dựa vào tính chất hóa học của Benzen và hợp chất thơm để hoàn thành bài tập
- Bốn chất đã cho đều tác dụng với H2 với xúc tác Ni
- Hexen và Etilen tác dụng với dung dịch Br2
- Benzen và Toluen tác dụng với Br2 có xúc tác Fe đun nóng
- Hexen, Toluen và Etilen tác dụng với KMnO4 đun nóng
- Hexen, Toluen và Etilen tác dụng với HBr
- Hexen và Etilen tác dụng với H2O (xt H+)
Hướng dẫn giải
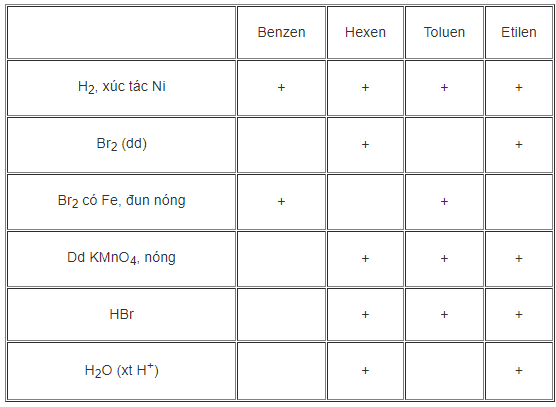
7. Giải bài 7 trang 160 SGK Hóa học 11
Cho benzen tác dụng với lượng dư HNO3 đặc có xúc tác H2SO4 đặc để điều chế nitrobenzen. Tính khối lượng nitrobenzen thu được khi dùng 1,00 tấn benzen với hiệu suất 78%.
Phương pháp giải
Viết PTHH xảy ra, tính toán khối lượng nitrobenzen theo khối lượng phản ứng của benzen.
C6H6 + HNO3 đặc →C6H5NO2 + H2O
%H=luongpuluongbd.100%
→ mbenzen pư =?
→ mnitrobenzen =?
Hướng dẫn giải
Vì %H =78% → Khối lượng C6H6 tham gia phản ứng là:
mC6H6pu=78%100%=0,78(tan)
C6H6 + HNO3 đặc → C6H5NO2 + H2O
Theo PT: 78 (gam) 123 (gam)
Hay 78 (tấn) → 123 (tấn)
Vậy theo ĐB: 0,78 (tấn) → x (tấn)
→ x=0,78.12378=1,23 (tấn)
8. Giải bài 8 trang 160 SGK Hóa học 11
So sánh tính chất hóa học của etylbenzen với stiren, viết phương trình hóa học của các phản ứng để minh họa.
Phương pháp giải
Dựa vào các kiến thức đã học để so sánh điểm giống và khác nhau giữa etylbenzen và stiren
→ Từ đo viết phương trình hóa học minh họa
Hướng dẫn giải
So sánh tính chất hoá học của etylbenzen với stiren
Giống nhau: Đều tham gia phản ứng thế
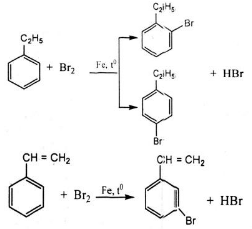
Khác nhau:
+ Etylbenzen có tính chất giống ankan:
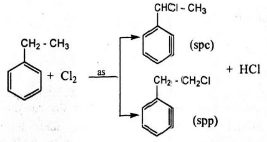
+ Stiren có tính chất giống anken:
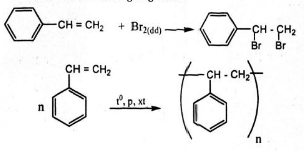
9. Giải bài 9 trang 160 SGK Hóa học 11
Phương pháp giải
Stiren có CTCT là: C6H5CH=CH2
Ghi nhớ: quy tắc cộng zaixep khi tác nhân cộng không đối xứng
a) HOH cộng vào liên kết đôi C=C với sản phẩm chính là H vào cacbon bậc thấp ( chứa nhiều H hơn) cho sản phẩm chính
b) tương tự a
c) Cộng H2 tỉ lệ 1: 1 chỉ cộng vào liên kết C=C
Hướng dẫn giải
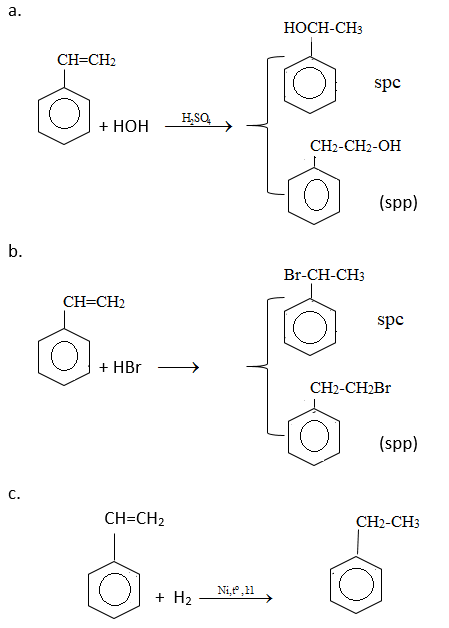
10. Giải bài 10 trang 160 SGK Hóa học 11
Trình bày phương pháp hóa học phân biệt 3 chất lỏng sau: toluen, benzen, stiren. Viết phương trình hóa học của các phản ứng đã dùng.
Phương pháp giải
Dùng dung dịch KMnO4
ở điều kiên thường stiren làm mất màu dd thuốc tím → nhận ra được stirren
Khi đun nóng thì toluen làm mất màu dd thuốc tím → nhận ra toluen
Còn lại là benzen
Hướng dẫn giải
Cho 3 chất lỏng tác dụng với dung dịch KMnO4 ở nhiệt độ thường, chất nào làm mất màu dung dịch KMnO4 ở nhiệt độ thường là stiren.
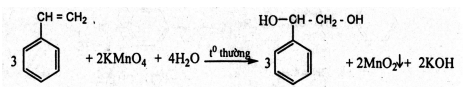
- Với 2 hỗn hợp phản ứng còn lại ta đem đun nóng, chất nào làm mất màu dung dịch KMnO4(nóng) thì là toluen, còn lại là benzen.
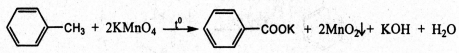
11. Giải bài 11 trang 160 SGK Hóa học 11
Khi tách hiđro của 66,25 kg etylbenzen thu được 52 kg stiren. Tiến hành phản ứng trùng hợp toàn bộ lượng stiren này thu được hỗn hợp A gồm polistiren và phần stiren chưa tham gia phản ứng. Biết 5,2 gam A vừa đủ làm mất màu của 60.00 ml dung dịch brom 0,15 M.
a)Tính hiệu suất của phản ứng tách hiđro của etylbezen.
b) Tính khối lượng stiren đã trùng hợp.
c) Polistiren có phân tử khối trung bình bằng 3,12.105. Tính hệ số trùng hợp trung bình của polime.
Phương pháp giải
Tính số mol của etybenzen, stiren
a) %H = (số mol stiren/ số mol etylbenzen).100%
b) Từ mol Brom → số mol của stiren dư trong 5,2 g. Từ đó suy ra được khối lượng stiren dư trong 52 kg
→ Khối lượng stiren pư = 52 - m stiren dư
c) Hệ số trùng hợp polime n=3,12.105Mpolistiren=?
Hướng dẫn giải
nC6H5C2H5 = 66,25 : 106 = 0,625 (kmol)
nC6H5CH=CH2 = 52 : 104 = 0,5 (kmol)
nBr2 = 0,06.0,15 = 0,009 mol
a) C6H5CH2-CH3 → C6H5CH=CH2 + H2 (1)
0,5 0,5
%H=0,50,625.100%=80%
b) nC6H5CH=CH2 → (-CH(C6H5)-CH-)n (2)
C6H5CH=CH2 + Br2 (dd) → C6H5CHBr-CH2Br (3)
nStire dư = nBr2 = 0,009 (mol) → mSitren dư = 0,009.104 = 0,936 (g)
Theo định luật bảo toàn khối lượng: mtrước = msau→ mA = mstiren = 52 (kg)
Cứ 5,2 gam A thì khối lượng stiren dư là 0,936 (g)
→ 52 kg A có khối lượng stiren dư là x (gam)
→ 52.0,9365,2=9,36(kg)
Vậy khối lương stiren đã tham gia phản ứng là: 52 – 9,36 = 42, 64 (kg)
c) Hệ số trùng hợp là: n=3,12.105104=3000
12. Giải bài 12 trang 161 SGK Hóa học 11
Trình bày cách đơn giản để thu được naphtalen tinh khiết từ hỗn hợp naphtalen có lẫn tạp chất không tan trong nước và không bay hơi.
Phương pháp giải
Dựa vào tính chất hóa học của naphtalen đề lựa chọn phương pháp tách chất phù hợp
Do Naphtalen dễ bay hơi tạo thành hơi dễ cháy → Do đó ta lựa chọn phương pháp bay hơi để thu được naphtalen tinh khiết
Hướng dẫn giải
Úp miệng phễu có gắn giấy đục lỗ trên hỗn hợp naphtalen và tạp chất, đun nóng, naphatalen thăng hoa tạo các tinh thể hình kim bám trên mặt giấy, thu được naphtalen tinh khiết.
13. Giải bài 13 trang 161 SGK Hóa học 11
Từ etilen và benzen, tổng hợp được stiren theo sơ đồ:
C6H6 C2H4→H+ C6H5CH2CH3 xt,to→ C6H5CH = CH2
a) Viết các phương trình hóa học thực hiện các biến đổi trên.
b) Tính khối lượng stiren thu được từ 1,00 tấn benzen nếu hiệu suất của quá trình là 78%.
Phương pháp giải
a) C6H6 + C2H4 → C6H5 – CH2 - CH3
C6H5CH2CH3 → C6H5CH = CH2 + H2
b) %H=luongphanungluongbandau.100%→mC6H6pu=luongbandau.%H100%
Từ PTHH: tính số mol stiren theo số mol của benzen => m stiren =?
Hướng dẫn giải
a) C6H6 + C2H4 → C6H5 – CH2 - CH3
C6H5CH2CH3 → C6H5CH = CH2 + H2
b) Theo sơ đồ: C6H6 → C6H5CH2CH3 → C6H5CH = CH2
mC6H6pu=1.106.78%100%=78.104(g)nC6H6pu=78.10478=104(mol)
nStiren = nC6H6 pư = 104 (mol)
→ mStiren = 104. 104 = 1040000 (g) = 1,04 (tấn)
Tham khảo thêm
- doc Giải bài tập SGK Hóa 11 Bài 36: Luyện tập Hiđrocacbon thơm
- doc Giải bài tập SGK Hóa 11 Bài 37: Nguồn hiđrocacbon thiên nhiên
- doc Giải bài tập SGK Hóa 11 Bài 38: Hệ thống hóa về hiđrocacbon




