Giải bài tập SGK Hóa 11 Bài 19: Luyện tập: TCHH của cacbon, silic và hợp chất của chúng
Nội dung hướng dẫn Giải bài tập Hóa 11 Bài 19 dưới đây sẽ giúp các em học sinh nắm vững phương pháp giải bài tập và ôn luyện tốt kiến thức về tính chất hóa học của cacbon, silic và hợp chất của chúng. Mời các em cùng theo dõi.
Mục lục nội dung

Giải bài tập SGK Hóa 11 Bài 19: Luyện tập: TCHH của cacbon, silic và hợp chất của chúng
1. Giải bài 1 trang 86 SGK Hóa học 11
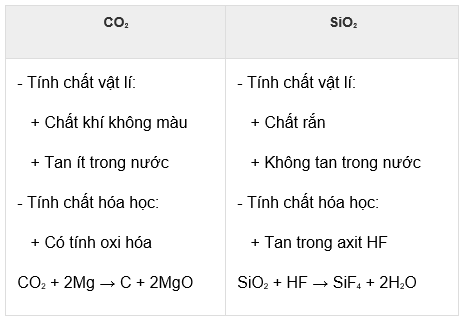
Nêu các điểm giống và khác nhau về tính chất giữa cacbon đioxit và silic đioxit?
Phương pháp giải
Để so sánh tính chất giữa cacbon đioxit và silic đioxit cần nắm rõ tính chất vật lý và hóa học của các oxit đó.
Hướng dẫn giải
Điểm giống và khác nhau về tính chất giữa cacbon đioxit và silic đioxit
- Giống nhau: đều là oxit axit
CO2 + 2NaOH → Na2CO3 + H2O
SiO2 tan chậm trong kiềm đặc nóng, tan dễ trong kiềm nóng chảy:
SiO2 + 2NaOHn,c → Na2SiO3 + H2O
- Khác nhau:
2. Giải bài 2 trang 86 SGK Hóa học 11
Phản ứng hóa học không xảy ra ở những cặp chất nào sau đây?
a) C và CO
b) CO2 và NaOH
c) K2CO3 và SiO2
d) H2CO3 và Na2SiO3
e) CO và CaO
g) CO2 và Mg
h) SiO2 và HCl
i) Si và NaOH
Phương pháp giải
Để xác định cặp phản ứng đã cho có phản ứng xảy ra hay không cần ghi nhớ:
Phản ứng hóa học không xảy ra khi cả 2 chất đều có tính hóa học tương tự nhau;hoặc phản ứng không sinh ra chất kết tủa, chất bay hơi
Ví du: cùng có tính khử, cùng có tính oxi hóa mạnh sẽ không phản ứng được với nhau
Hướng dẫn giải
Phương trình hóa học có xảy ra phản ứng:
b) CO2 + 2NaOH → Na2CO3 + H2O (hoặc CO2 + NaOH → NaHCO3)
d) H2CO3 + Na2SiO3 → Na2CO3 + H2SiO3 ↓
g) 2Mg + CO2 → C + 2MgO
i) Si + 2NaOH + H2O → Na2SiO3 + 2H2
Vậy phản ứng không xảy ra ở các cặp chất a, c, e, h.
3. Giải bài 3 trang 86 SGK Hóa học 11
Có các chất sau: CO2, Na2 CO3, C, NaOH, Na2SiO3, H2SiO3. Hãy lập thành một dãy chuyển hóa giữa các chất và viết phương trình hóa học.
Phương pháp giải
Để lập dãy chuyển hóa cần nắm rõ tính chất tính chất hóa học của silic, cacbon và hợp chất của chúng.
Hướng dẫn giải
Dãy chuyển hóa giữa các chất:
C → CO2→ Na2CO3→ NaOH→ Na2SiO3→ H2SiO3
Các phương trình hóa học:
C + O2 → CO2
CO2 + 2NaOH → Na2CO3↓ + H2O
Na2 CO3 + Ba(OH)2 → BaCO3 + 2NaOH
SiO2 + 2NaOH → Na2SiO3 + H2O
Na2SiO3 + 2HCl → H2SiO3 + 2NaCl
4. Giải bài 4 trang 86 SGK Hóa học 11
Cho 5,94 g hỗn hợp K2CO3 và Na2CO3 tác dụng với dung dịch H2SO4 dư thu được 7,74 g hỗn hợp các muối khan K2SO4 và Na2SO4. Thành phần hỗn hợp đầu là
A. 3,18 g Na2CO3 và 2,76 g K2CO3
B. 3,81 g Na2CO3 và 2,67 g K2CO3
C. 3,02 g Na2CO3 và 2,25 g K2CO3
D. 4,27 g Na2CO3 và 3,82 g K2CO3
Phương pháp giải
- Bước 1: Gọi x và y lần lượt là số mol của K2CO3 và Na2CO3
K2CO3 + H2SO4 → K2SO4 + H2O + CO2↑
x → x (mol)
Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2↑
y → y (mol)
- Bước 2: Giải hệ phương trình:
∑mhh = 138x + 106y = 5,94
∑mmuoikhan = 174x + 142y = 7,74
=> x = ? y = ?
=> mK2CO3 và mNa2CO3 =?
Hướng dẫn giải
Gọi số mol của Na2CO3 là x (mol) và của K2CO3 y (mol)
Na2CO3 + H2SO4 → Na2SO4 + CO2 + H2O
x (mol) → x (mol)
K2CO3 + H2SO4 → K2SO4 + CO2 + H2O
y (mol) → y (mol)
Ta có hệ phương trình:
{106x+138y=5,94142x+174y=7,74⇒{x=0,03y=0,02
→ mNa2CO3 = 0,03.106 = 3,18 gam
→ mK2CO3 = 0,02.138 = 2,76 gam
5. Giải bài 5 trang 86 SGK Hóa học 11
Để đốt cháy 6,80g hỗn hợp X gồm hidro và cacbon monooxit cần 8,96 lít oxi (đo ở đktc). Xác định thành phần phần trăm theo thể tích và theo khối lượng của hỗn hợp X?
Phương pháp giải
- Bước 1: Gọi x và y lần lượt là số mol của CO và
Viết PTHH:
2CO + O2 to→ 2CO2 (1)
x mol x/2 mol x mol
2H2 + O2 to→ 2H2O (2)
y mol y/2 mol y mol
Số mol oxi: 8,96/22,4 = 0,4 (mol)
- Bước 2: Theo đầu bài ta có: x + y = 0,8; 28x + 2y = 6,80
Tính ra: x = ?; y= ?
- Bước 3: Từ đó tính được thành phần phần trăm theo thể tích và theo số mol.
Hướng dẫn giải
Phương trình hóa học:
2CO + O2 2CO2 (1)
x x/2 x mol
2H2 + O2 2H2O (2)
y y/2 y mol
Số mol oxi: 8,96 : 22,4 = 0,4 (mol)
Ta có hệ phương trình:
{x+y=0,828x+2y=6,8
⇒ x = 0,2; y= 0,6
Phần trăm thể tích bằng phần trăm số mol:
%VCO=0,20,8.100%=25%
%VH2=0,60,8.100%=75%
Phần trăm tính theo khối lượng:
%mH2=0,6.26,8.100%=17,6%
%mCO=100%−17,6%=82,4%
6. Giải bài 6 trang 86 SGK Hóa học 11
Một loại thủy tinh có thành phần hóa học được biểu diễn bằng công thức K2O.PbO.6SiO2. Tính khối lượng K2CO3, PbCO3 và SiO2 cần dùng để có thể sản xuất được 6,77 tấn thủy tinh trên. Coi hiệu suất qua trình là 100%.
Phương pháp giải
- Bước 1: Tính số mol của thủy tinh n = m : MK2O.PbO.6SiO2 =?
- Bước 2: Từ đó tính được số mol của K2CO3, PbCO3 và SiO2 cần dùng
Hướng dẫn giải
Số mol thuỷ tinh là:
6,77.106677=0,01.106(mol)
Từ công thức của thuỷ tinh suy ra:
nK2CO3 = nPbCO3 = nthuỷ tinh = 0,01.106 mol
→ Khối lượng K2CO3 = 0,01. 106. 138(g) = 1,38. 106(g) = 1,38 (tấn)
→ Khối lượng PbCO3 = 0,01. 106. 267(g) = 2,67. 106(g) = 2,67(tấn)
nSiO2 = 6nthuỷ tinh = 6. 0,01. 106 mol = 0,06. 106 mol
→ Khối lượng SiO2 = 0,06. 106. 60(g) = 3,6 tấn
Vậy để nấu được 6,77 tấn thủy tinh trên cần dùng 1,38 tấn K2CO3, 2,67 tấn PbCO3 và 3,6 tấn SiO2
Tham khảo thêm
- doc Giải bài tập SGK Hóa 11 Bài 15: Cacbon
- doc Giải bài tập SGK Hóa 11 Bài 16: Hợp chât của cacbon
- doc Giải bài tập SGK Hóa 11 Bài 17: Silic và hợp chất của silic
- doc Giải bài tập SGK Hóa 11 Bài 18: Công nghiệp silicat




