Giải bài tập SGK Hóa 10 Nâng cao Bài 8: Luyện tập Chương 1
Giải bài tập 1, 2, 3, 4, 5, 6, 7, 8 trang 34 sách giáo khoa Hóa 10 nâng cao được eLib sưu tầm và tổng hợp. Tài liệu sẽ giúp các bạn học sinh hệ thống lại những kiến thức đã học trong bài, định hướng phương pháp giải các bài tập cụ thể. Ngoài ra việc tham khảo tài liệu còn giúp các bạn học sinh rèn luyện và nâng cao kỹ năng giải bài tập. Mời các bạn cùng tham khảo!
Mục lục nội dung
1. Giải bài 1 trang 34 SGK Hóa học 10 nâng cao
2. Giải bài 2 trang 34 SGK Hóa học 10 nâng cao
3. Giải bài 3 trang 34 SGK Hóa học 10 nâng cao
4. Giải bài 4 trang 34 SGK Hóa học 10 nâng cao
5. Giải bài 5 trang 34 SGK Hóa học 10 nâng cao
6. Giải bài 6 trang 34 SGK Hóa học 10 nâng cao

1. Giải bài 1 trang 34 SGK Hóa 10 nâng cao
Dãy nào trong các dãy gồm các phân lớp electron đã bão hòa?
A. s1,p3,d7,f12
B. s2,p5,d9,f13
C. s2,p4,d10,f11
D. s2,p6,d10,f14.
Phương pháp giải
Cần nắm vững khái niệm cấu hình bão hòa
Cấu hình bão hoà là khi phân lớp đạt số electron tối đa.
Ví dụ phân lớp s điền đủ 2 e, p điền đủ 6 e, d điền đủ 10 e.
Ví dụ: Mg có cấu hình 1s22s22p63s2
Hướng dẫn giải
Dãy gồm các phân lớp electron đã bão hòa là s2, p6, d10, f14.
→ Chọn D.
2. Giải bài 2 trang 34 SGK Hóa 10 nâng cao
Cấu hình electron ở trạng thái cơ bản của nguyên tử kim loại nào sau đây có electron độc thân ở obitan s?
A. Crom
B. Coban
C. Sắt
D. Mangan
E. Niken
Phương pháp giải
Viết cấu hình electron của các chất → phân tích cấu hình để rút ra kết luận đúng
Hướng dẫn giải
Cấu hình của các nguyên tử:
Cr (Z = 24): 1s22s22p63s23p64s13d5
Theo lý thuyết thì phải là 4s23d4 nhưng 1e ở 4s2 đã nhảy vào 3d4 để cấu hình đạt mức bán bão hòa vì vậy mà crom có e độc thân ở phân lớp s (4s1).
Fe (Z = 26): 1s22s22p63s23p64s23d6 → không có electron độc thân ở obitan s.
Mn (Z = 25): 1s22s22p63s23p64s23d5 → không có electron độc thân ở obitan s.
Ni (Z = 28): 1s22s22p63s23p64s23d8 → không có electron độc thân ở obitan s.
→ Đáp án A
3. Giải bài 3 trang 34 SGK Hóa 10 nâng cao
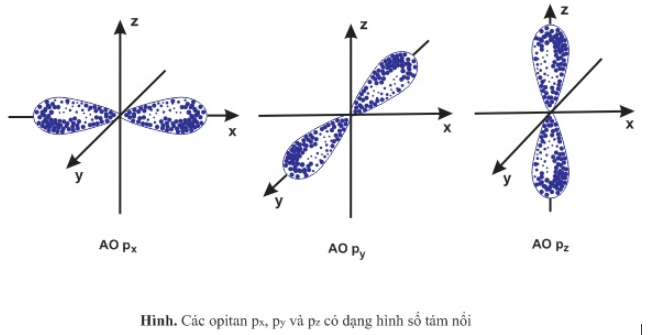
Năng lượng của các obitan 2px,2py,2pz có khác nhau không? Vì sao?
Phương pháp giải
Hướng dẫn giải
Năng lượng của các obitan 2px,2py,2pz không khác nhau.
Vì phân lớp p có 3obitan trên cùng 1 phân lớp có mức năng lượng như nhau chỉ khác nhau về sự định hướng trong không gian.
4. Giải bài 4 trang 34 SGK Hóa 10 nâng cao
Hãy cho biết số electron tối đa:
a) Trong các lớp K, N, M.
b) Trong các phân lớp s, p, d, f.
Phương pháp giải
Xác định số electron tối đa dựa vào công thức 2n3
Trong đó n là số lớp electron
Hướng dẫn giải
Câu a:
Số e tối đa trong 1 lớp được tính theo công thức 2n3
+ Lớp K có n = 1 → số e tối đa 2.12 = 2
+ Lớp N có n = 4 → số e tối đa là 2.42=43
+ Lớp M có n = 3 → số e tối đa là 2.32=18
Câu b:
Trong phân lớp s có 1 obitan → số electron tối đa là 2
Trong phân lớp p có 3 obitan → số electron tối đa là 6
Trong phân lớp d có 5 obitan → Số electron tối đa là 10
Trong phân lớp f có 7 obitan → số electron tối đa là 14
5. Giải bài 5 trang 34 SGK Hóa 10 nâng cao
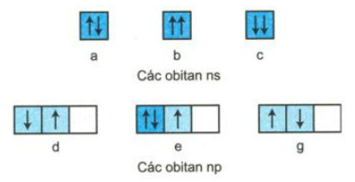
Sự phân bố các electron vào mỗi obitan nguyên tử ở trạng thái cơ bản sau được viết đúng qui ước không? Hãy giải thích?
Phương pháp giải
- Nguyên lí Pau-li
Trên 1 obitan có tối đa 2e và 2e này chuyển động tự quay khác chiều nhau:
- Nguyên lí bền vững
Ở trạng thái cơ bản, trong nguyên tử các electron chiếm lần lượt các obitan có mức năng lượng từ thấp đến cao.
- Quy tắc Hun
Trong 1 phân lớp, các electron sẽ phân bố trên các obitan sao cho số electron độc thân là tối đa và có chiều tự quay giống nhau.
Hướng dẫn giải
Câu a: Viết đúng quy ước.
Câu b: Không viết đúng quy ước (Theo nguyên lí Pau-li: 2 electron trên 1 obitan chuyển động tự quay khác chiều nhau xung quanh trục riêng của mỗi electron).
Câu c: Không viết đúng quy ước (Theo nguyên lí Pau-li: 2 electron trên 1 obitan chuyển động tự quay khác chiều nhau xung quanh trục riêng của mỗi electron).
Câu d: Không viết đúng quy ước (Theo quy tắc Hun: trong cùng 1 phân lớp, các electron phân bố trên các obitan sao cho số electron độc thân là tối đa và các electron này phải có chiều tự quay giống nhau).
Câu e: Viết đúng qui ước.
Câu g: Không viết đúng qui ước. (Theo quy tắc Hun: trong cùng 1 phân lớp, các electron phân bố trên các obitan sao cho số electron độc thân là tối đa và các electron này phải có chiều tự quay giống nhau).
→ Giải thích: Sự xắp xếp các electron vào các obitan theo dựa theo quy tắc Hun, nguyên lý Pau-li, nguyên lí bền vững.
6. Giải bài 6 trang 34 SGK Hóa 10 nâng cao
Khi số hiệu nguyên tử Z tăng, trật tự năng lượng AO tăng dần theo chiều từ trái qua phải và đúng trật tự từ thấy lên cao theo như dãy sau không?
1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6s 5d 6p 7s 5f 6d ...
Nếu sai, hãy sửa lại cho đúng.
Phương pháp giải
Viết lại phân bố mức năng lượng sao cho phù hợp với quy tắc
Hướng dẫn giải
Khi số hiệu nguyên tử Z tăng, trật tự năng lượng AO tăng dần theo chiều từ trái qua phải và trật tự từ thấp lên cao theo dãy:
1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6s 5d 6p 7s 5f 6d ... là sai
Sửa lại là: 1s 2s 2p 3s 3p 4s 4p 3d 4f 5s 4d f 5s 4d 5p 6s 5d 6p 7s 5f 6d …
7. Giải bài 7 trang 34 SGK Hóa 10 nâng cao
Viết cấu hình electron nguyên tử của các nguyên tố có Z = 15, Z = 17, Z = 20, Z = 21, Z = 31.
Phương pháp giải
Viết cấu hình electron tuân theo ba bước sau:
B1: Điền lần lượt các e vào các phân lớp theo thứ tự tăng dần mức năng lượng.
B2: Sắp xếp lại theo thứ tự các lớp và phân lớp theo nguyên tắc từ trong ra ngoài.
B3: Xem xét phân lớp nào có khả năng đạt đến bão hòa hoặc bán bão hòa thì có sự sắp xếp lại các electron ở các phân lớp (chủ yếu là d và f)
Hướng dẫn giải
Cấu hình e nguyên tử của các nguyên tố có:
Z = 15: 1s2 2s2 2p6 3s2 3p3
Z = 17: 1s2 2s2 2p6 3s2 3p5
Z = 20: 1s2 2s2 2p6 3s2 3p6 4s2
Z = 21: 1s2 2s2 2p6 3s2 3p6 3d1 4s2
Z = 31: 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p1
8. Giải bài 8 trang 34 SGK Hóa 10 nâng cao
Nguyên tử Fe có Z = 26. Hãy viết cấu hình electorn của Fe. Nếu nguyên tử Fe bị mất hai electron, mất ba electron thì các cấu hình electron tương ứng sẽ như thế nào?
Phương pháp giải
Viết cấu hình electron tuân theo ba bước sau:
B1: Điền lần lượt các e vào các phân lớp theo thứ tự tăng dần mức năng lượng.
B2: Sắp xếp lại theo thứ tự các lớp và phân lớp theo nguyên tắc từ trong ra ngoài.
B3: Xem xét phân lớp nào có khả năng đạt đến bão hòa hoặc bán bão hòa thì có sự sắp xếp lại các electron ở các phân lớp (chủ yếu là d và f)
Hướng dẫn giải
Fe (Z = 26): 1s2 2s2 2p6 3s2 3p6 3d6 4s2
Fe2+ (Z = 26): 1s2 2s2 2p6 3s2 3p6 3d6
Fe3+ (Z = 26): 1s2 2s2 2p6 3s2 3p6 3d5
Tham khảo thêm
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 1: Thành phần nguyên tử
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 2: Hạt nhân nguyên tử, Nguyên tố hóa học
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 3: Đồng vị, Nguyên tử khối và nguyên tử khối trung bình
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 4: Sự chuyển động của electron trong nguyên tử, Obitan nguyên tử
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 5: Luyện tập
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 6: Lớp và phân lớp electron
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 7: Năng lượng của các electron trong nguyên tử, Cấu hình electron nguyên tử



