Giải bài tập SGK Hóa 10 Nâng cao Bài 25: Phản ứng oxi hóa khử
eLib xin chia sẻ với các bạn nội dung giải bài tập SGK bài Phản ứng oxi hóa khử. Với các bài tập có phương pháp giải và lời giải chi tiết, hi vọng rằng đây sẽ là tài liệu giúp các bạn học tập tốt hơn.
Mục lục nội dung

1. Giải bài 1 trang 102 SGK Hóa 10 nâng cao
Một nguyên tử lưu huỳnh (S) chuyển thành ion sunfua (S2-) bằng cách:
A. nhận thêm một electron.
B. nhường đi một electron,
C. nhận thêm hai electron.
D. nhường đi hai electron.
Hãy tìm đáp án đúng.
Phương pháp giải
Chất oxh (chất bị khử) là chất thu electron.
Hướng dẫn giải
Một nguyên tử lưu huỳnh (S) chuyển thành ion sunfua (S2-) bằng cách nhận thêm hai electron.
Đáp án C
2. Giải bài 2 trang 103 SGK Hóa 10 nâng cao
Trong phản ứng: Cl2 + 2KBr → Br2 + 2KCl, nguyên tố clo:
A. chỉ bị oxi hóa.
B. chỉ bị khử.
C. không bị oxi hóa, cũng không bị khử.
D. vừa bị oxi hóa, vừa bị khử.
Hãy tìm đáp án đúng.
Phương pháp giải
- Chất khử (chất bị oxh) là chất nhường electron
- Chất oxh (chất bị khử) là chất thu electron.
- Quá trình oxh (sự oxh) là quá trình nhường electron.
- Quá trình khử (sự khử) là quá trình thu electron.
Hướng dẫn giải
Chọn B.
\(\mathop {C{l_2}}\limits^0 + 2e \to 2\mathop {Cl}\limits^{ - 1} \)
Sự khử ⇒ Cl2 là chất oxi hóa (chất bị khử).
3. Giải bài 3 trang 103 SGK Hóa 10 nâng cao
Trong phản ứng: 2Fe(OH)3 → Fe2O3 + 3H2O, nguyên tố sắt:
A. bị oxi hóa.
B. bị khử.
C. không bị oxi hóa, cũng không bị khử.
D. vừa bị oxi hóa, vừa bị khử.
Hãy tìm đáp án đúng.
Phương pháp giải
- Chất khử (chất bị oxh) là chất nhường electron
- Chất oxh (chất bị khử) là chất thu electron.
- Quá trình oxh (sự oxh) là quá trình nhường electron.
- Quá trình khử (sự khử) là quá trình thu electron.
Hướng dẫn giải
Chọn C.
Vì số oxi hóa của Fe trước và sau phản ứng không đổi nên bị oxi hóa, cũng không bị khử.
4. Giải bài 4 trang 103 SGK Hóa 10 nâng cao
Các câu sau đây đúng hay sai?
a) Sự đốt cháy natri trong khí clo là một phản ứng oxi hóa – khử.
b) Na2O bao gồm các ion Na2+ và O2−.
c) Khi tác dụng với CuO, CO là chất khử.
d) Sự oxi hóa ứng với sự giảm số oxi hóa của một nguyên tố
e) Sự khử ứng với sự tăng số oxi hóa của một nguyên tố.
Phương pháp giải
Để giải bài tập này cần nắm vững khả năng oxi hóa của một số chất
Hướng dẫn giải
Câu đúng là a, c.
Câu sai là b, d, e.
5. Giải bài 5 trang 103 SGK Hóa 10 nâng cao
Tính số oxi hóa của:
a) cacbon trong CH4, CO, C, CO2, CO32-, HCO3- .
b) lưu huỳnh trong SO2, H2SO3, S2-, S, SO32-, HSO4-, HS-.
c) clo trong ClO4- , ClO- , Cl2, Cl-, ClO3, Cl2O7.
Phương pháp giải
1. Cách xác định Hóa trị trong hợp chất ion
+ Hóa trị của một nguyên tố trong hợp chất ion gọi là điện hóa trị và bằng điện tích của ion đó.
+ Trị số điện hóa trị của một nguyên tố bằng số electron mà nguyên tử của nguyên tố đó nhường hoặc thu để tạo thành ion.
2. Cách xác định hóa trị trong hợp chất cộng hóa trị
+ Trong hợp chất cộng hoá trị, hoá trị của một nguyên tố được xác định bằng số liên kết của nguyên tử nguyên tố đó trong phân tử và được gọi là cộng hoá trị của nguyên tốt đó.
+ Trong các hợp chất cộng hóa trị có cực hay không cực, số liên kết xung quanh nguyên tử được xác định bằng số cặp electron chung tạo ra liên kết.
Hướng dẫn giải
Câu a: Số oxi hóa của cacbon lần lượt là: +4, +2, 0, +4, +4, +4
Câu b: Số oxi hóa của lưu huỳnh lần lượt là: +4, +4, -2, 0, +4, + 6, -2
Câu c: Số oxi hóa của clo lần lượt là: +7, +1, 0, -1, +5, +7
6. Giải bài 6 trang 103 SGK Hóa 10 nâng cao
Lập các phương trình hóa học của phản ứng oxi hóa - khử theo các sơ đồ dưới đây và xác định vai trò của từng chất trong phản ứng:
a) Na2SO3 + KMnO4 + H2O → Na2SO4 + MnO2 + KOH
b) FeSO4 + K2Cr2O7 + H2SO4 → Fe2(SO4)3 + K2SO4 + Cr2(SO4)2 + H2O
c) Cu + HNO3 → Cu(NO3)2 + NO2 + H2O
d) Cu + HNO3 → Cu(NO3)2 + NO + H2O
e) Fe3O4 + HNO3 → Fe(NO3)3 + NO + H2O
g) Fe + H2SO4 → Fe2(SO4)3 + SO2 + H2O
h) Cl2 + NaOH → NaCl + NaClO + H2O.
Phương pháp giải
Các bước để lập PTHH bằng phương pháp thăng bằng electron
1. Xác định sự thay đổi số oxi hóa của các nguyên tố trong sơ đồ phản ứng.
2. Viết các quá trình oxi hóa và khử, cân bằng mỗi quá trình.
3. Tìm hệ số thích hợp để để nhân vào sao cho tổng số electron mà chất khử nhường bằng tổng số eletron mà chất oxi hóa nhận.
4. Đặt hệ số của chất khử và chất oxi hóa vào sơ đồ phản ứng.Hoàn thành phương trình hóa học.
Hướng dẫn giải
Câu a: Na2S+4O3 + KMn+7O4 + H2O → Na2S+6O4 + Mn+4O2 + KOH
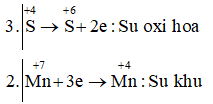
3Na2SO3 + 2KMnO4 + H2O → 3Na2SO4 + MnO2 + KOH
Vậy Na2SO3 là chất khử; KMnO4 là chất oxi hóa và H2O là môi trường.
Câu b: Fe+2SO4 + K2Cr+62O7 + H2SO4 → Fe+32(SO4)3 + K2SO4 + Cr+32(SO4)2 + H2O
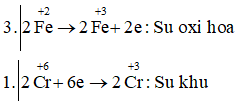
6FeSO4 + K2Cr2O7 + 7H2SO4 → 3Fe2(SO4)3 + K2SO4+ Cr2(SO4)2 + 7H2O
Vậy FeSO4 là chất khử; K2Cr2O7 là chất oxi hóa và H2SO4 là môi trường.
Câu c: Cuo + HN+5O3 → Cu+2(NO3)2 + N+4O2 + H2O
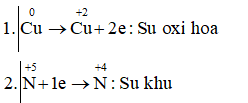
Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O
Vậy chất khử là Cu, chất oxi hóa và môi trường là HNO3
Câu d: Cuo + HN+5O3 → Cu+2(NO3)2 + N+2O + H2O
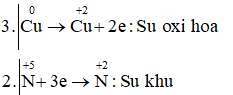
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 2H2O
Vậy chất khử là Cu, chất oxi hóa và môi trường là HNO3
Câu e: Fe+8/33O4 + HN+5O3 → Fe+3(NO3)3 + N+2O + H2O
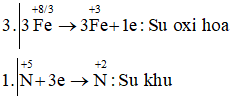
3Fe3O4 + 28HNO3 → 9Fe(NO3)3 + NO + 14H2O
Vậy chất khử là Fe3O4; chất oxi hóa và môi trường là HNO3
Câu g: Feo + H2S+6O4 → Fe+32(SO4)3 + S+4O2 + H2O
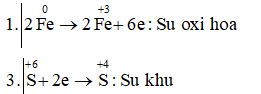
2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2 + 6H2O
Vậy chất khử là Fe; chất oxi hóa và môi trường là H2SO4
Câu h: Clo2 + NaOH → NaCl-1 + NaCl+1O + H2O.
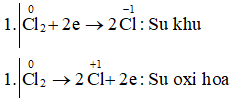
Cl2 + 2NaOH → NaCl + NaClO + H2O.
7. Giải bài 7 trang 104 SGK Hóa 10 nâng cao
Điiot pentaoxit (I2O5) tác dụng với cacbon monoxit tạo ra cacbon đioxit và iot.
a) Lập phương trình hóa học của phản ứng oxi hóa - khử trên.
b) Khi cho một lít hỗn hợp có chứa CO và CO2 tham gia phản ứng thì khối lượng điiot pentaoxit bị khử là 0,5 gam. Tính thành phần phần trăm về thể tích của CO trong hỗn hợp khí. Biết rằng ở điều kiện thí nghiệm, thể tích mol của chất khí V = 24 lít.
Phương pháp giải
Viết phương trình hóa học → tính theo phương trình
Hướng dẫn giải
Câu a: Phương trình phản ứng
I+52O5 + C+2O → C+4O2 + I2o
1x 2I+5 + 10e → 2Io : Sự khử
5x C+2 → C+4 + 2e : Sự oxi hóa
I2O5 + CO → CO2 + I2
Câu b: Tính phần trăm về thể tích CO trong hỗn hợp khí:
Chỉ có CO tham gia phản ứng. Theo phương trình phản ứng:
nCO = 5nI2O5 = (5.0,5)/334 = 5/668 mol
VCO = (24. 5)/668 ≈ 0,18 lit
⇒ %VCO = 0,18.100% ≈ 18%
Tham khảo thêm
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 26: Phân loại phản ứng trong hóa học vô cơ
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 27: Luyện tập Chương 4



