Giải bài tập SGK Hóa 10 Nâng cao Bài 18: Sự lai hóa các obitan nguyên tử
Dưới đây là Hướng dẫn giải Hóa 10 SGK nâng cao Chương 3 Bài 18 Sự lai hóa các obitan nguyên tử, sự hình thành liên kết đơn, liên kết đôi và liên kết ba được eLib biên soạn và tổng hợp, nội dung bám sát theo chương trình SGK Hóa học 10 nâng cao giúp các em học sinh nắm vững phương pháp giải bài tập và ôn tập kiến thức hiệu quả hơn.
Mục lục nội dung
1. Giải bài 1 trang 80 SGK Hóa học 10 nâng cao
2. Giải bài 2 trang 80 SGK Hóa học 10 nâng cao
3. Giải bài 3 trang 80 SGK Hóa học 10 nâng cao
4. Giải bài 4 trang 80 SGK Hóa học 10 nâng cao
5. Giải bài 5 trang 80 SGK Hóa học 10 nâng cao
6. Giải bài 6 trang 80 SGK Hóa học 10 nâng cao

1. Giải bài 1 trang 80 SGK Hóa 10 nâng cao
Thế nào là sự lai hóa?
Phương pháp giải
Để giải bài tập này cần nắm vững khái niệm lai hóa, sự lai hóa
Hướng dẫn giải
Sự lai hóa obitan nguyên tử là sự tổ hợp “trộn lẫn” một số obitan trong một nguyên tử để được từng ấy obitan lai hóa giống nhau nhưng định hướng khác nhau trong không gian.
2. Giải bài 2 trang 80 SGK Hóa 10 nâng cao
Lấy các ví dụ minh họa ba kiểu lai hóa đã học.
Phương pháp giải
Cần nắm vững kiến thức về 3 loại lai hóa sp, sp2 và sp3 để đưa ra ví dụ chính xác
Hướng dẫn giải
Lai hóa sp (phân tử BeH2), sp2 (phân tử BF3), sp3 (phân tử CH4)
3. Giải bài 3 trang 80 SGK Hóa 10 nâng cao
Mô tả liên kết hóa học trong phân tử BeH2, phân tử BF3, phân tử CH4 theo thuyết lai hóa.
Phương pháp giải
- Phân tử BeH2 lai hóa sp
- Phân tử BF3 lai hóa sp2
- Phân tử CH4 lai hóa sp3
Hướng dẫn giải
- Phân tử BeH2: Một obitan s và một obitan p của nguyên tử beri tham gia lai hóa để tạo thành 2 obitan lai hóa sp hướng về hai phía đối xứng nhau. Hai obitan này sẽ xen phủ với 2 obitan ls chứa 1 electron của hai nguyên tử hiđro tạo thành 2 liên kết σ giữa Be – H.
Sơ đồ:

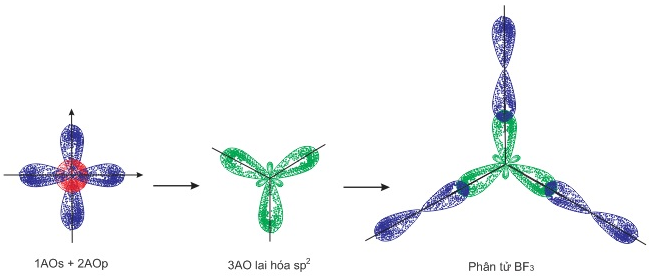
- Phân tử BF3: Trong nguyên tử B một obitan s tham gia lai hóa với 2 obitan p tạo thành 3 obitan lai hóa sp2 định hướng từ tâm đến 3 đỉnh của tam giác đều. 3 obitan này xen phủ với 3 obitan p của flo để tạo thành 3 liên kết σ giữa B-F.
Sơ đồ:
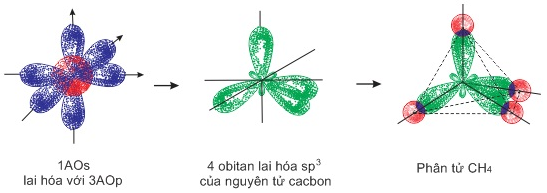
- Phân tử CH4: 1AOs và 3AOp của nguyên tử cacbon đã tiến hầnh lai hóa để tạo thành 4 obitan lai hóa sp3 định hướng từ tâm đến 4 đỉnh của hình tứ diện đều, các trục đối xứng của chúng tạo với nhau 1 góc 109o28’. 4 obitan lai hóa sp3 sẽ xen phủ với 4 obitan s của 4 nguyên tử H để tạo 4 liên kết σ giữa C-H.
Sơ đồ:
4. Giải bài 4 trang 80 SGK Hóa 10 nâng cao
Mô tả sự hình thành liên kết trong các phân tử H2O, NH3 nhờ sự lai hóa sp các AO hóa trị của các nguyên tử O và N. Hãy mô tả hình dạng của các phân tử đó.
Phương pháp giải
- Phân tử H2O và phân tử NH3 đều là lai hóa sp3
Hướng dẫn giải
∗ Phân tử H2O:
- Một obitan 2s và 3 obitan 2p của nguyên tử O lai hóa với nhau tạo nên 4 obitan lai hóa sp3 giống hệt nhau, hướng về 4 đỉnh của hình tứ diện đều. Trên 2 obitan lai hóa có electron độc thân; còn trên hai obitan lai hóa khác có cặp electron ghép đôi.
- Hai electron lai hóa chứa electron độc thân xen phủ với obitan ls chứa electron độc thân của hai nguyên tử hiđro, tạo nên hai liên kết σ.
- Phân tử H2O Có dạng góc.
∗ Phân tử NH3:
- 1 obitan 2s và 3 obitan 2p của nguyên tử N lai hóa với nhau tạo nên 4 obitan lai hóa sp3 giống hệt nhau, hướng về 4 đỉnh của hình tứ diện đều. Trên 3 obitan lai hóa có electron độc thân. Trên obitan lai hóa còn lại có cặp electron ghép đôi.
- 3 obitan lai hóa chứa electron độc thân xen phủ với 3 obitan ls chứa electron độc thân của 3 nguyên tử hiđro, tạo nên 3 liên kết σ.
- Phân tử NH3 có dạng hình chóp tam giác.
5. Giải bài 5 trang 80 SGK Hóa 10 nâng cao
Thế nào là sự xen phủ trục và sự xen phủ bên? Lấy ví dụ minh họa.
Phương pháp giải
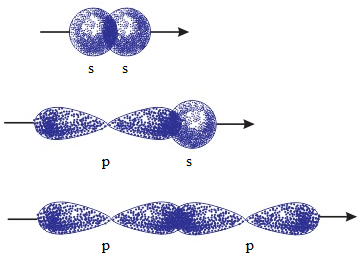
- Sự xen phủ trong đó trục của các obitan tham gia liên kết trùng với đường lối tâm của hai nguyên tử liên kết gọi là sự xen phủ trục
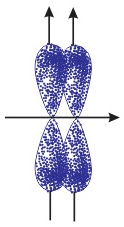
- Sự xen phủ trong đó trục của các obitan tham gia liên kết song song với nhau và vuông góc với đường nối tâm của hai nguyên tử liên kết được gọi là sự xen phủ bên
Hướng dẫn giải
- Sự xen phủ trục: Sự xen phủ trong đó trục của các obitan tham gia liên kết trùng với đường lối tâm của hai nguyên tử liên kết gọi là sự xen phủ trục. Sự xen phủ trục tạo liên kết σ.
- Sự xen phủ bên: Sự xen phủ trong đó trục của các obitan tham gia liên kết song song với nhau và vuông góc với đường nối tâm của hai nguyên tử liên kết được gọi là sự xen phủ bên. Sự xen phủ bên tạo liên kết π.
6. Giải bài 6 trang 80 SGK Hóa 10 nâng cao
Thế nào là liên kết σ, liên kết π và nêu tính chất của chúng?
Phương pháp giải
- Liên kết σ được hình thành do sự xen phủ trục
- - Liên kết π là liên kết được hình thành do sự xen phủ bên
Hướng dẫn giải
Câu a:
Liên kết σ:
- Liên kết σ được hình thành do sự xen phủ giữa hai obitan hóa trị của hai nguyên tử tham gia liên kết dọc theo trục liên kết.
- Tính chất của liên kết σ là đối xứng qua trục liên kết, các nguyên tử tham gia liên kết quay quanh trục liên kết. Liên kết σ bền hơn các loại liên kết khác.
Câu b:
Liên kết π
- Liên kết π là liên kết được hình thành do sự xen phủ giữa 2 obitan hóa trị của 2 nguyên tử tham gia liên kết ở hai bên trục liên kết (xen phủ bên).
- Tính chất của liên kết π là không có tính đối xứng trục, nên hai nguyên tử tham gia liên kết không có khả năng quay quanh trục liên kết và kém bền hơn các liên kết khác.
7. Giải bài 7 trang 80 SGK Hóa 10 nâng cao
Thế nào là liên kết đơn? Liên kết đôi? Liên kết ba? Cho ví dụ.
Phương pháp giải
Để giải bài tập này các em cần phân biệt được 3 loại liên kết đơn, đôi và ba
Hướng dẫn giải
- Liên kết đơn là liên kết do sự xen phủ 2 obitan liên kết theo dọc trục liên kết.
Ví dụ: Phân tử HBr: H-Br.
- Liên kết đôi là liên kết được hình thành do 2 cặp electron liên kết. Trong liên kết đôi có 1 liên kết σ (bền hơn) và 1 liên kết π (kém bền hơn).
Ví dụ: Phân tử CO: C=O.
- Liên kết ba là liên kết được hình thành do 3 cặp electron liên kết. Trong liên kết ba có 1 liên kết σ và 2 liên kết π.
Ví dụ: Phân tử axetilen: H-C ≡ C-H.
8. Giải bài 8 trang 80 SGK Hóa 10 nâng cao
Mô tả sự hình thành các liên kết trong phân tử HCl, C2H4, CO2, N2.
Phương pháp giải
- Phân tử HCl lai hóa sp
- Phân tử C2H4 lai hóa sp2
- Phân tử CO2 lai hóa sp
- Phân tử N2 lai hóa sp3
Hướng dẫn giải
- Phân tử HCl: Obian 1s chứa electron độc thân của nguyên tử hiđro xen phủ với obitan 3p chứa electron độc thân của nguyên tử clo, tạo thành một liên kết σ.
- Phân tử C2H4: Trong phân tử etilen (C2H4) mỗi nguyên tử cacbon có sự lai hóa sp2. Các obitan lai hóa tạo một liên kết σ giữa hai nguyên tử cacbon và hai liên kết σ với hai nguyên tử hiđro. Mỗi nguyên tử cacbon còn một obitan p không tham gia lai hóa sẽ xen phủ bên với nhau tạo liên kết π. Liên kết giữa hai nguyên tử cacbon là liên kết đôi.
- Phân tử CO2: Phân tử CO2 có dạng đường thẳng, nguyên tử cacbon lai hóa sp. Hai obitan lai hóa chứa electrón độc thân của nguyên tử c xen phủ trục với 2 obitan 2p chứa electrón độc thân của 2 nguyên tử oxi, tạo thành 2 liên kết σ. Hai obitan 2p không lai hóa của nguyên tử cacbon có chứa electron độc thân xen phủ bên với 2 obitan 2p chứa electron độc thân còn lại của 2 nguyên tử oxi, tạo nên 2 liên kết π.
- Phân tử N2: Mỗi nguyên tử nitơ có 3 electron độc thân nằm trên 3 obitan 2p; 2 obitan 2p của hai nguyên tử nitơ xen phủ trục, tạo nên 1 liên kết σ. Các obitan p còn lại xen phủ bên với nhau từng đôi một tạo nến 2 liên kết K. Như vậy, 2 nguyên tử nitơ liên kết với nhau bằng một liên kết σ và 2 liên kết π.
Tham khảo thêm
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 16: Khái niệm về liên kết hóa học, liên kết ion
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 17: Liên kết cộng hóa trị
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 19: Luyện tập
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 20: Tinh thể nguyên tử, tinh thể phân tử
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 21: Hiệu độ âm điện và liên kết hóa học
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 22: Hóa trị và số oxi hóa
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 23: Liên kết kim loại
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 24: Luyện tập Chương 3



