Giải bài tập SGK Hóa 10 Nâng cao Bài 13: Ý nghĩa của bảng tuần hoàn các NTHH
Dưới đây là nội dung chi tiết Giải bài tập nâng cao Hóa 10 Chương 2 Bài 13, với hướng dẫn giải chi tiết, rõ ràng, trình bày khoa học. eLib hy vọng đây sẽ là tài liệu hữu ích giúp các bạn học sinh lớp 10 học tập thật tốt
Mục lục nội dung
1. Giải bài 1 trang 57 SGK Hóa học 10 nâng cao
2. Giải bài 2 trang 58 SGK Hóa học 10 nâng cao
3. Giải bài 3 trang 58 SGK Hóa học 10 nâng cao
4. Giải bài 4 trang 58 SGK Hóa học 10 nâng cao
5. Giải bài 5 trang 58 SGK Hóa học 10 nâng cao
6. Giải bài 6 trang 58 SGK Hóa học 10 nâng cao
7. Giải bài 7 trang 58 SGK Hóa học 10 nâng cao
8. Giải bài 8 trang 58 SGK Hóa học 10 nâng cao

1. Giải bài 1 trang 57 SGK Hóa 10 nâng cao
Theo quy luật biến đổi tính chất của các nguyên tố trong bảng tuần hoàn thì:
A. phi kim mạnh nhất là iot.
B. kim loại mạnh nhất là liti.
C. phi kim mạnh nhất là flo.
D. kim loại yếu nhất là xesi.
Chọn đáp án đúng.
Phương pháp giải
Nắm vững quy luật biến đổi tuần hoàn tính chất của các nguyên tố
Hướng dẫn giải
Theo quy luật biến đổi tính chất của các nguyên tố trong bảng tuần hoàn thì phi kim mạnh nhất là flo.
Chọn C.
2. Giải bài 2 trang 58 SGK Hóa 10 nâng cao
Cho nguyên tố X (Z = 12), hãy cho biết:
- Cấu hình electron nguyên tử của nguyên tố X.
- Tính chất hóa học cơ bản của nguyên tố X.
Phương pháp giải
- Viết cấu hình electron của X, từ cấu hình suy ra các tính chất cơ bản
Hướng dẫn giải
Cấu hình electron nguyên tử của X: 1s22s22p63s2
Tính chất hóa học cơ bản của nguyên tố X.
- Là kim loại, có tính kim loại khá mạnh.
- Hóa trị cao nhất với oxi là 2. Công thức oxit: XO.
- Công thức hợp chất hiđroxit: X(OH)2.
- Oxit và hiđroxit có tính bazơ.
3. Giải bài 3 trang 58 SGK Hóa 10 nâng cao
Dựa vào quy luật biến đổi tính kim loại, tính phi kim của các nguyên tố trong bảng tuần hoàn, hãy nêu:
a) Nguyên tố nào là kim loại mạnh nhất? Nguyên tố nào là phi kim mạnh nhất.
b) Các nguyên tố kim loại được phân bố ở khu vực nào trong bảng tuần hoàn?
c) Các nguyên tố phi kim được phân bố ở khu vực nào trong bảng tuần hoàn?
d) Nhóm nào gồm những nguyên tố kim loại điển hình? Nhóm nào gồm những nguyên tố phi kim điển hình?
e) Các nguyên tố khí hiếm nằm ở khu vực nào trong bảng tuần hoàn?
Phương pháp giải
Để giải bài tập này cần nắm được quy luật biến đổi tính kim loại, tính phi kim của các nguyên tố trong bảng tuần hoàn
Hướng dẫn giải
Câu a: Kim loại mạnh nhất: Cs; Phi kim mạnh nhất: F.
Câu b: Các nguyên tố kim loại phân bố ở khu vực phía, bên trái BTH.
Câu c: Các nguyên tố phi kim phân bố ở khu vực phía, bên phải BTH.
Câu d: Nhóm IA gồm những nguyên tố kim loại điển hình. Nhóm VIIA gồm những nguyên tố phi kim loại điển hình.
Câu e: Các nguyên tố khí hiếm thuộc nhóm VIIIA.
4. Giải bài 4 trang 58 SGK Hóa 10 nâng cao
Nguyên tử của hai nguyên tố có Z = 25 và Z = 35.
a) Xác định số thứ tự chu kì và nhóm của các nguyên tố trên trong bảng tuần hoàn.
b) Nêu tính chất hóa học cơ bản của hai nguyên tố đó.
Phương pháp giải
Từ Z → Cấu hình electron → Xác định số thứ tự chu kì, nhóm → Tính chất hóa học
Hướng dẫn giải
Nguyên tử có Z = 25:
Cấu hình electron nguyên tử của các nguyên tố A(Z = 25): 1s22s22p63s23p63d54s2.
Vị trí: A có STT = 25, thuộc chu kì 4, nhóm VIIB.
Tính chất: Là kim loại chuyển tiếp. Hóa trị cao nhất với oxi là 7. Công thức oxit cao nhất là A2O7.
Nguyên tử có Z = 35:
Cấu hình electron nguyên tử của nguyên tố B(Z = 35): ls2 2s2 2p6 3s2 3p6 3d10 4s2 4p5
Vị trí: B có STT = 35, thuộc chu kì 4, nhóm VIIA.
Tính chất: Là phi kim mạnh. Hóa trị với hiđro là 1 Công thức hợp chất với hiđro là HB. Hóa trị cao nhất của B với oxi là 7.
Công thức oxit cao nhất là B2O7 là oxit axit.
5. Giải bài 5 trang 58 SGK Hóa 10 nâng cao
Nguyên tô X có số hiệu nguyên tử là 16.
- Viết cấu hình electron nguyên tử của nguyên tố X.
- Cho biết tính chất hóa học cơ bản của nguyên tố X.
Phương pháp giải
Từ Z → Cấu hình electron → Xác định số thứ tự chu kì, nhóm → Tính chất hóa học
Hướng dẫn giải
X có Z = 16.
Cấu hình electron nguyên tử: 1s22s22p63s23p4.
Tính chất hóa học cơ bản:
- Là phi kim vì thuộc nhóm VIA trong BTH.
- Hóa trị cao nhất với oxi là 6; công thức oxit cao nhất: XO3
- Hóa trị cao nhất với hiđro là 2; công thức hợp chất khí với hiđro: H2X.
- Oxit XO3 là oxit axit.
6. Giải bài 6 trang 58 SGK Hóa 10 nâng cao
Bảng dưới đây cho biết bán kính nguyên tử và năng lượng ion hóa thứ nhất của nguyên tử một số nguyên tố.
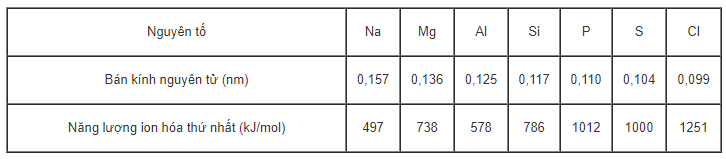
Dựa vào các dữ kiện trên, hãy rút ra những nhận xét sau:
a) Sự biến đổi bán kính nguyên tử của các nguyên tố trong chu kì.
b) Sự biến đổi năng lượng ion hóa I1 của nguyên tử các nguyên tố trong chu kì.
Phương pháp giải
Quan sát bảng, rút ra nhận xét
Hướng dẫn giải
Câu a: Trong một chu kì, từ trái sang phải, bán kính nguyên tử giảm dần.
Câu b: Trong một chu kì, từ trái sang phải, năng lượng ion hóa I1 tăng dần.
7. Giải bài 7 trang 58 SGK Hóa 10 nâng cao
Phát biểu định luật tuần hoàn và cho biết nguyên nhân của sự biến đổi tuần hoàn tính kim loại, tính phi kim của các nguyên tố theo chiều tăng của điện tích hạt nhân nguyên tử.
Phương pháp giải
Để giải bài tập này cần nắm vững nội dung định luật tuần hoàn
Hướng dẫn giải
Định luật: “Tính chất của các nguyên tố và đơn chất cũng như thành phần và tính chất của các hợp chất tạo nên từ các nguyên tố đó biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử”.
Nguyên nhân: Tính kim loại, tính phi kim của các nguyên tố phụ thuộc chủ yếu vào cấu hình electron nguyên tử của các nguyên tố trong bảng tuần hoàn có tính biến đổi tuần hoàn nên tính kim loại, tính phi kim biên đổi tuần hoàn.
8. Giải bài 8 trang 58 SGK Hóa 10 nâng cao
Nguyên tố clo thuộc chu kì 3 và nhóm VIIA, hãy cho biết đặc điểm và cấu hình electron nguyên tử và tính chất hóa học cơ bản của clo.
Phương pháp giải
Nguyên tố clo → Z = 17 → Cấu hình
→ Tính chất hóa học đặc trưng
Hướng dẫn giải
Cấu hình electron nguyên tử của clo: 1s22s22p63s23p5.
Tính chất hóa học cơ bản:
- Hóa trị cao nhất với oxi là 7; Công thức oxit cao nhất: Cl2O7.
- Hóa trị với hiđro là 1: Công thức hợp chất khí với hiđro: HCl.
- Oxit Cl2O7 là oxit axit. Axit HClO4 là axit rất mạnh.
9. Giải bài 9 trang 58 SGK Hóa 10 nâng cao
Nguyên tố natri thuộc chu kì 3 và nhóm IA, hãy cho biết đặc điểm về cấu hình electron nguyên tử và tính chất hóa học cơ bản của natri.
Phương pháp giải
Nguyên tố Na có Z = 11 → Cấu hình electron
→ Tính chất hóa học cơ bản
Hướng dẫn giải
Cấu hình electron nguyên tử của Na: 1s22s22p63s1 .
Tính chất hóa học cơ bản:
- Là kim loại điển hình.
- Hóa trị cao nhất với oxi là 1: Công thức oxit: Na2O.
- Công thức hợp chất hiđroxit NaOH
- Oxit và hidroxit có tính bazo mạnh.
10. Giải bài 10 trang 58 SGK Hóa 10 nâng cao
Hãy so sánh tính kim loại của Mg (Z = 12) với Na (Z = 11) và Al (Z = 13).
Phương pháp giải
Từ Z của các nguyên tố → Cấu hình electron → Tính chất hóa học cơ bản
Hướng dẫn giải
Cấu hình electron nguyên tử của các nguyên tố:
Na (Z = 11) 1s22s22p63s1
Mg (Z = 12) 1s22s22p63s2.
Al (Z = 13) 1s22s22p63s23p1
Nguyên tử của 3 nguyên tố trên đều có 3 lớp electron nên chúng đều thuộc chu kì 3. Chúng lần lượt có số electron lớp ngoài cùng là 1, 2, 3 nên đều là những kim loại. Theo quy luật về sự biến đổi tính kim loại - phi kim, Mg có tính kim loại yếu hơn Na nhưng mạnh hơn Al.
Theo quy luật về sự biến đổi tính kim loại – phi kim: Trong cùng 1 chu kì theo chiều tăng dần điện tích hạt nhân tính kim loại giảm dần.
Do đó: Mg có tính kim loại yếu hơn Na nhưng mạnh hơn Al.
Tham khảo thêm
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 9: Bảng tuần hoàn các nguyên tố hóa học
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 10: Sự biến đổi tuần hoàn cấu hình electron nguyên tử của các NTHH
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 11: Sự biến đổi một số đại lượng vật lí của các nguyên tố hóa học
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 12: Sự biến đổi tính KL, tính phi kim của các NTHH, định luật tuần hoàn
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 14: Luyện tập chương 2



