Hoá học 9 Bài 56: Ôn tập cuối năm
Phần Ôn tập cuối năm luyện tập về mối quan hệ qua lại giữa các loại hợp chất vô cơ và kim loại, phi kim; Tính chất hóa học cơ bản của một số hợp chất hữu cơ. Vận dụng để giải một số bài tập liên quan.
Mục lục nội dung

1. Tóm tắt lý thuyết
1.1. Hóa vô cơ
Mối quan hệ giữa các loại chất vô cơ
.png)
1.2. Hóa hữu cơ
a. Công thức cấu tạo
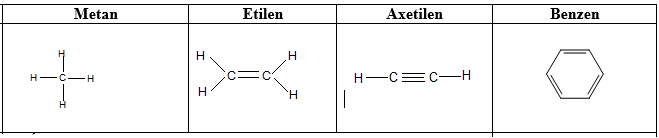
b. Tính chất hóa học
+ Rượu etylic, axit axetic, chất béo
- Rượu etylic:
- Công thức: C2H5OH
- Phản ứng đốt cháy:
C2H5OH +3O2 \(\overset{t^{0}}{\rightarrow}\) 2CO2 + 3H2O
- Phản ứng với Na:
2C2H5OH + 2Na → 2C2H5ONa + H2
- Phản ứng este hóa:
CH3COOH + C2H5OH \(\rightleftharpoons\) CH3COOC2H5 + H2O
- Ứng dụng: Dùng làm rượu bia, nước giải khát, nhiên liệu, nguyên liệu điều chế các chất hữu cơ,…
- Axit axetic:
- Công thức: CH3COOH
- Phản ứng đốt cháy:
CH3COOH + 3O2 \(\overset{t^{0}}{\rightarrow}\) 2CO2 + 2H2O
- Phản ứng với dung dịch kiềm:
CH3COOH + NaOH → CH3COONa + H2O
- Phản ứng với Na:
2CH3COOH + 2Na → 2CH3COONa + H2
- Phản ứng este hóa:
CH3COOH + C2H5OH \(\rightleftharpoons\) CH3COOC2H5 + H2O
- Tác dụng với muối của axit yếu hơn:
2CH3COOH + CaCO3 → (CH3COO)2Ca + CO2 + H2O
- Ứng dụng: Nguyên liệu để tổng hợp chất dẻo, phẩm nhuộm,dược phẩm,…
- Chất béo:
- Công thức: (RCOO)3C3H5
- Phản ứng đốt cháy:
(RCOO)3C3H5 + O2 \(\overset{t^{0}}{\rightarrow}\) CO2 + H2O
- Phản ứng thủy phân:
Chất béo + Nước \(\overset{axit,t^{0}}{\rightarrow}\) Glixerin + các axit béo
- Phản ứng với dung dịch kiềm:
Chất béo + dd kiềm → Glixerin + Các muối của axit béo
- Ứng dụng: Là thành phần cơ bản trong thức ăn của người và động vật, cung cấp năng lượng,…
+ Glucozơ, saccarozơ, tinh bột và xenlulozơ
- Glucozơ:
- Công thức: C6H12O6
- Phản ứng Oxi hóa:
C6H12O6 + Ag2O\(\overset{NH_{3}}{\rightarrow}\) C6H12O7 + 2Ag
- Phản ứng lên men:
C6H12O6 \(\overset{men\,\,giam}{\rightarrow}\)2C2H5OH + 2CO2
- Saccarozơ:
- Công thức: C12H22O11
- Phản ứng thủy phân:
C12H22O11 + H2O \(\xrightarrow[t^{0}]{Axit}\) C6H12O6 + C6H12O6
- Tinh bột và xenlulozơ:
- Công thức: (-C6H10O5-)n
- Phản ứng thủy phân: (–C6H10O5 –)n + nH2O \(\xrightarrow[t^{0}]{Axit}\) nC6H12O6
- Phản ứng với iot: tạo màu xanh tím
2. Bài tập minh họa
2.1. Dạng 1: Xác định công thức phân tử
Đốt cháy 4,5 gam chất hữu cơ A thu được 6,6 gam khí CO2 và 2,7gam H2O. Xác định công thức phân tử hợp chất hữu cơ A. Biết khối lượng mol của hợp chất là 60 gam.
Hướng dẫn giải
Đốt cháy hợp chất hữu cơ cho CO2 và H2O, hợp chất hữu cơ này chắc chắn có hai nguyên tố C và H, có thể có nguyên tố O.
\({m_C} = \frac{{{m_{C{O_2}}}}}{{44}}.12 = \frac{{6,6}}{{44}}.12 = 1,8(gam)\)
\({m_H} = 2.{n_{{H_2}O}} = 2.\frac{{2,7}}{{18}} = 0,3(gam)\)
mA = mC + mH + mO
⇒ mO = mA - (mC + mH) = 4,5 - (1,8 + 0,3) = 2,4 gam
Hợp chất hữu cơ có nguyên tố O.
Đặt công thức phân tử hợp chất hữu cơ A là CxHyOz.
Ta có tỉ lệ:
\(\begin{array}{l}
x:y:z = \frac{{{m_C}}}{{12}}:\frac{{{m_H}}}{1}:\frac{{{m_O}}}{{16}}\\
= \frac{{1,8}}{{12}}:\frac{{0,3}}{1}:\frac{{2,4}}{{16}}
\end{array}\)
\(= 0,15:0,3:0,15 = 1:2:1\)
Công thức đơn giản nhất của A là (CH2O)n
Khối lượng mol của hợp chất là 60 gam ⇒ MA = 60
(CH2O)n ⇒ 30n = 60 ⇒ n = 2
Vậy công thức phân tử hợp chất hữu cơ A là C2H4O2.
2.2. Dạng 2: Bài tập nhận biết
Nêu các phương pháp hóa học để nhận biết các chất sau: CH4, C2H2, CO2
- Cho các khí qua dung dịch Ca(OH)2 dư:
Khí nào cho kết tủa là khí CO2
CO2 + Ca(OH)2 dư → CaCO3 + H2O
- Lấy cùng một thể tích các khí còn lại cho tác dụng với cùng một thể tích dung dịch brom có cùng nồng độ:
Khí làm nhạt màu dung dịch brom là C2H4
C2H4 + Br2 → C2H4Br2
Khí không làm mất màu dung dịch brom là CH4
2.3. Dạng 3: Sơ đồ phản ứng
Viết các phương trình hóa học thực hiện chuyển đổi hóa học sau:
Tinh bột \(\xrightarrow{{(1)}}\) Glucozơ \(\xrightarrow{{(2)}}\) Rượu Etylic \(\xrightarrow{{(3)}}\) Axit axetic \(\xrightarrow{{(4)}}\) Etyl axetat \(\xrightarrow{{(5)}}\) Rượu Etylic
Hướng dẫn giải
Các phương trình hóa học như sau:
(1) (C6H10O5)n + nH2O \(\xrightarrow{{{H^ + },{t^o}}}\) nC6H12O6
(2) C6H12O6 \(\xrightarrow{{xt,{t^o}}}\) 2C2H5OH + 2CO2
(3) 2C2H5OH + O2 \(\xrightarrow{{men,{t^o}}}\) 2CH3COOH + 2H2O
(4) CH3COOH + C2H5OH \(\overset {{H_2}S{O_4},{t^o}} \leftrightarrows \) CH3COOC2H5 + H2O
(5) CH3COOC2H5 + NaOH → C2H5OH + CH3COONa
2.4. Dạng 4: Tính chất của kim loại
Hỗn hợp 3 kim loại Fe, Al, Cu nặng 17,4 gam. Nếu hòa tan hỗn hợp bằng axit H2SO4 loãng dư thì thoát ra 8,96 dm3 H2 (ở đktc). Còn nếu hòa tan hỗn hợp bằng axit đặc nóng, dư thì thoát ra 12,32 dm3 SO2 (ở đktc). Tính khối lượng mỗi kim loại ban đầu.
Hướng dẫn giải
Cu không tan trong H2SO4 loãng, chỉ có Fe và Al tan được trong axit loãng
Fe + H2SO4 → FeSO4 + H2↑
2Al + 3H2SO4→ Al2(SO4)3 + 3H2↑
H2SO4 đặc nóng hòa tan cả 3 kim loại:
2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2↑ + 6H2O
2Al + 6H2SO4 → Al2(SO4)3 + 3SO2↑ + 6H2O
Cu + 2H2SO4 → CuSO4 + SO2↑ + 2H2O
Số mol H2 = 0,4; số mol SO2 = 0,55 mol
Gọi số mol của Fe, Al, Cu lần lượt là x, y, z ta có :
\(\left\{ \begin{array}{l} 56x{\rm{ }} + {\rm{ }}27y{\rm{ }} + {\rm{ }}64z{\rm{ }} = {\rm{ }}17,4\\ x{\rm{ }} + {\rm{ }}1,5y = 0,4\\ 1,5x{\rm{ }} + {\rm{ }}1,5y{\rm{ }} + {\rm{ }}z{\rm{ }} = {\rm{ }}0,55 \end{array} \right. \Rightarrow \left\{ \begin{array}{l} x = 0,1(mol)\\ y = 0,2(mol)\\ z = 0,1(mol) \end{array} \right.\)
Khối lượng của sắt ban đầu là: mFe = 0,1. 56 = 5,6 (gam)
Khối lượng của nhôm ban đầu là: mAl = 0,2. 27 = 5,4 (gam)
Khối lượng của đồng ban đầu là: mCu = 0,1. 64 = 6,4 (gam)
2.5. Dạng 5: Phản ứng tráng bạc
Nhỏ 10ml dung dịch AgNO3 1M trong NH3 vào ống nghiệm đựng dung dịch glucozo dư, sau khi kết thúc phản ứng, người ta thu được một lượng Ag cân nặng 0,864g. Tính hiệu suất phản ứng (Ag=108)
Hướng dẫn giải
nAgNO3 ban đầu = 0,01 mol.
nAg tạo ra = 0,864/108 = 0,008 mol
Hiệu suất phản ứng = (0,008/0,01).100% = 80%
3. Luyện tập
3.1. Bài tập tự luận
Câu 1: Nêu các phương pháp hóa học để nhận biết các chất sau:
a) C2H5OH, CH3COOC2H5, CH3COOH
b) Dung dịch glucozơ, dung dịch saccarozơ, dung dịch axit axetic.
Câu 2: Hoàn thành các phương trình hóa học sau:
Fe2(SO4)3 + ? → Fe(NO3)3 + ?
AlCl3 + ? → Al2(SO4)3 + ?
Al2O3 + KHSO4 → ? + ? + ?
KHCO3 + Ca(OH)2 → ? + ? + ?
NaCl + ? → NaOH + ?
Ca(HCO3)2 + ? → CaCO3↓ + ?
Câu 3: Đốt cháy hoàn toàn 0,295 gam chất hữu cơ X chứa C, H, O thu được 0,44 gam CO2, 0,225 gam H2O. Trong một thí nghiệm khác, khi phân tích một lượng chất X như trên cho 55,8 cm3 N2 (đo ở đktc). Tỉ khối hơi của X so với H2 là 29,5. Lập CTHH và CTPT của X.
Câu 4: Nhúng một thanh sắt vào dung dịch CuSO4 sau một thời gian lấy thanh sắt ra khổi dung dịch cân lại thấy nặng thêm 0,8g. Khối lượng dung dịch giảm so với ban đầu là bao nhiêu gam (Cu=64, Fe=56)?
Câu 5: Cho 0,1 lít dung dịch glucozo 0,1M tác dụng vừa đủ với dung dịch AgNO3 trong NH3. Tính khối lượng Ag thu được (cho Ag = 108).
Câu 6: Cho các dung dịch sau: axit sunfuric loãng, axit axetic, rượu etylic. Bằng phương pháp hóa học nhận biết từng chất.
3.2. Bài tập trắc nghiệm
Câu 1: Chọn câu đúng:
A. Metan, etilen, axetilen đều làm mất màu dung dịch brom.
B. Etilen, axetilen, benzen đều làm mất màu dung dịch brom.
C. Etilen, axetilen đều làm mất màu dung dịch brom.
D. Metan, etilen, benzen đều làm mất màu dung dịch brom.
Câu 2: Dãy chất đều tan trong nước ở nhiệt độ thường là:
A. saccarozơ và tinh bột.
B. glucozơ và xenlulozơ
C. glucozơ và saccarozơ
D. saccarozơ và xenlulozơ.
Câu 3: Dãy các chất đều có phản ứng thủy phân:
A. tinh bột, xenlulozơ, PVC, glucozơ.
B. tinh bột, xenlulozơ, saccarozơ, chất béo.
C. tinh bột, xenlulozơ, saccarozơ, glucozơ.
D. tinh bột, xenlulozơ, saccarozơ, PE.
Câu 4: Để điều chế rượu etylic, một nhà khoa học đã cho lên men 54g glucozơ và tiến hành thí nghiệm tại 300 – 320C. Biết rằng phản ứng xảy ra hoàn toàn. Do đó, khối lượng rượu etylic thu được là:
A. 1,38 g
B. 2,76 g
C. 27,6 g
D. 13,8 g
4. Kết luận
Sau bài học cần nắm:
- Thiết lập được mối liên hệ giữa các chất vô cơ: kim loại, phi kim, oxit, axit, bazơ, muối.
- Vận dụng kiến thức đã học vào việc viết một số PTHH và làm một số bài tập hóa vô cơ.
Tham khảo thêm
- doc Hoá học 9 Bài 44: Rượu etylic
- doc Hoá học 9 Bài 45: Axit axetic
- doc Hoá học 9 Bài 46: Mối liên hệ giữa etilen, rượu etylic và axit axetic
- doc Hoá học 9 Bài 47: Chất béo
- doc Hoá học 9 Bài 48: Luyện tập Rượu etylic, axit axetic và chất béo
- doc Hoá học 9 Bài 49: Thực hành: Tính chất của rượu và axit
- doc Hoá học 9 Bài 50: Glucozơ
- doc Hoá học 9 Bài 51: Saccarozơ
- doc Hoá học 9 Bài 52: Tinh bột và xenlulozơ
- doc Hoá học 9 Bài 53: Protein
- doc Hoá học 9 Bài 54: Polime
- doc Hoá học 9 Bài 55: Thực hành: Tính chất của gluxit



