Hoá học 9 Bài 45: Axit axetic
Khi lên men dung dịch rượu etylic loãng người ta thu được giấm ăn, đó là dung dịch axit axetic. Vậy Axit axetic có công thức cấu tạo như thế nào? Nó có tính chất và ứng dụng ra sao? Chúng ta cùng tìm hiểu qua bài học sau.
Mục lục nội dung

1. Tóm tắt lý thuyết
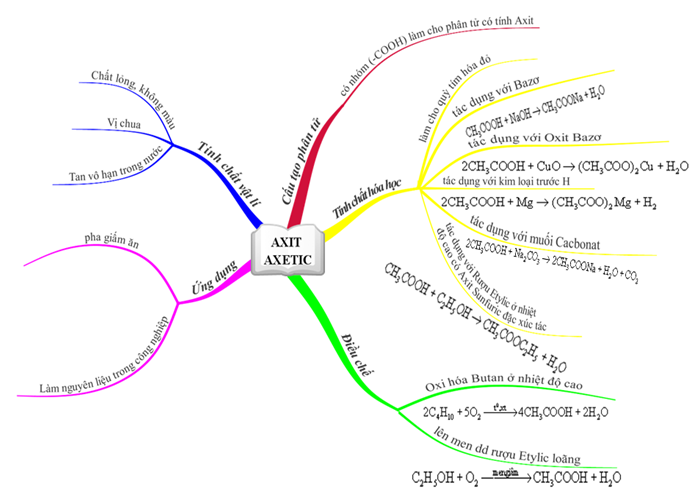
Công thức phân tử: C2H4O2
Phân tử khối: 60 g/mol
1.1. Tính chất vật lí
Axit axetic là chất lỏng, không màu, vị chua, tan vô hạn trong nước.
1.2. Cấu tạo phân tử
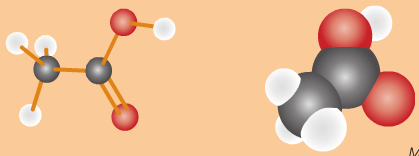
- Công thức cấu tạo:
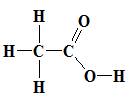
-
Công thức rút gọn: CH3 - COOH
-
Nhóm (–COOH) này làm cho phân tử có tính axit
1.3. Tính chất hóa học
a) Axit axetic có tính chất của một axit không?
Axit axetic là một axit hữu cơ mang tính chất của một axit. Tuy nhiên, axit axetic là một axit yếu.
- Làm hóa hồng quỳ tím.
- Tác dụng với kim loại: 2CH3COOH + Zn → (CH3COO)2Zn + H2\(\uparrow\) (có sủi bọt khí không màu)
- Tác dụng với bazơ: CH3COOH + NaOH → CH3COONa + H2O (chứng minh phản ứng đã xảy ra bằng cách cho chất chỉ thị màu phenolphtalein vào dung dịch kiềm trước thấy dung dịch màu hồng, sau đó kiềm bị trung hòa bởi axit làm màu hồng nhạt dần rối mất hẳn)
- Tác dụng với oxit bazơ: 2CH3COOH + CuO (bột, màu đen) → (CH3COO)2Cu + H2O (dung dịch Cu2+ màu xanh lam)
- Tác dụng với muối: 2CH3COOH + CaCO3 → (CH3COO)2Ca + CO2\(\uparrow\) + H2O (có sủi bọt khí không màu)
b) Axit axetic có phản ứng với rượu etylic không?
Rượu etylic tác dụng với axit axetic tạo etyl axetat theo phản ứng
C2H5OH + CH3COOH .png) CH3COOC2H5 + H2O
CH3COOC2H5 + H2O
1.4. Ứng dụng của axit axetic
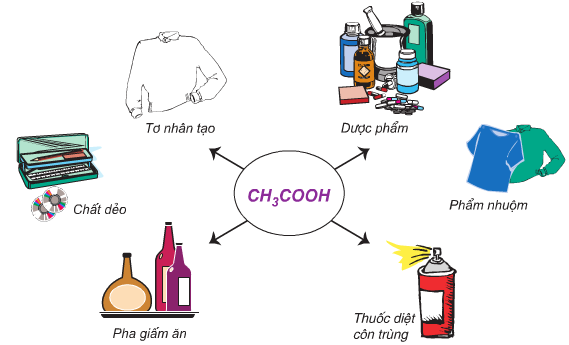
1.5. Điều chế
- Trong công nghiệp: Điều chế từ Butan theo phương trình
2C4H10 + 5O2 \(\overset{xt, t^{0}}{\rightarrow}\) 4CH3COOH + 2H2O
- Để sản xuất giấm ăn người ta thường dùng pp lên men dd rượu etylic loãng
C2H5OH + O2 \(\overset{men giam}{\rightarrow}\) CH3COOH+ H2O
1.6. Tổng kết
2. Bài tập minh họa
2.1. Dạng 1: Phản ứng este hóa
Cho 180 gam axit axetic tác dụng với 138 gam rượu etylic (có xúc tác axit). Sau khi phản ứng hoàn toàn đã có 44% lượng axit chuyển thành este. Tính khối lượng các chất thu được sau phản ứng.
Hướng dẫn giải
Lượng axit axetic tham gia phản ứng là: \({m_{C{H_3}COOH}} = 180.\frac{{44}}{{100}} = 79,2(gam)\)
Phương trình phản ứng:
CH3COOH + C2H5OH .png) CH3COOC2H5 + H2O
CH3COOC2H5 + H2O
M: 60 46 88
Ban đầu (gam): 180 138 0
Phản ứng (gam): 79,2 → \(\frac{{79,2.46}}{{60}} = 60,72\) → \(\frac{{79,2.88}}{{60}} = 116,16\)
Như vậy sau phản ứng:
Khối lượng axit axetic còn lại là: 180 - 79,2 = 108,8 (gam)
Khối lượng rượu etylic còn lại là: 138 - 60,72 = 77,28 (gam)
Khối lượng este thu được là: 116,16 (gam)
2.2. Dạng 2: Axit axetic tác dụng với dung dịch kiềm
Cho 150ml dung dịch axit axetic tác dụng hết với 100ml dung dịch NaOH 0,5M. Cô cạn dung dịch sau phản ứng thu được 3,26 gam chất rắn khan. Tính nồng độ mol của dung dịch axit axetic ban đầu.
Hướng dẫn giải
Vì đề bài không nói rõ là cho tác dụng với dung dịch NaOH vừa đủ hay dư nên sản phẩm sau khi cô cạn dung dịch sẽ chứa muối CH3COONa và có thể có thêm NaOH rắn, khan.
Phương trình hóa học:
CH3COOH + NaOH → CH3COONa + H2O
a (mol) → a (mol) → a (mol)
Gọi số mol NaOH dư là b
Ta có: Tổng số mol của NaOH là: a + b = 0,5.0,1 = 0,05 (1)
Số gam chất rắn khan thu được là: 82a + 40b = 3,26 (2)
Từ (1) và (2) ta có hệ phương trình:
\(\left\{ \begin{array}{l} a + b = 0,05\\ 82{\rm{a}} + 40b = 3,26 \end{array} \right. \Rightarrow \left\{ \begin{array}{l} a = 0,03(mol)\\ b = 0,02(mol) \end{array} \right.\)
Nồng độ mol của axit axetic ban đầu là: \({C_M} = \frac{n}{V} = \frac{{0,03}}{{0,15}} = 0,2(M)\)
3. Luyện tập
3.1. Bài tập tự luận
Câu 1: Cho dung dịch axit axetic nồng độ a% tác dụng vừa đủ với dung dịch NaOH nồng độ 10% thu được dung dịch muối có nồng độ 10,25%. Hãy tính a.
Câu 2: Hỗn hợp X gồm hai axit hữu cơ có công thức tổng quát CnH2n+1COOH với n ≥0. Cho 13,4 gam hỗn hợp X tác dụng với dung dịch NaOH 1M thì vừa hết V ml. Cô cạn dung dịch sau phản ứng thu được 17,8 gam hỗn hợp muối khan.
a) Xác định công thức phân tử của hai axit. Biết số mol của chúng trong hỗn hợp bằng nhau.
b) Tính V và thành phần % khối lượng của mỗi axit trong hỗn hợp.
Câu 3: Cho 30 gam axit axetic tác dụng với 92 gam rượu etylic có mặt H2SO4 đặc. Hãy tính số gam etyl axetat tạo thành, biết hiệu suất của phản ứng là 60%.
Câu 4: Tính khối lượng dung dịch axit axetic thu được khi lên men 50 lít rượu etylic 4°. Biết khối lượng riêng của rượu etylic là 0,8 g/ml và hiệu suất của quá trình lên men là 92%.
3.2. Bài tập trắc nghiệm
Câu 1: Axit axetic có tính axit do:
A. Là chất lỏng.
B. Tan vô hạn trong nước.
C. Có vị chua.
D. Nhóm – COOH.
Câu 2: Đun nóng axit axetic với rượu etylic có axit sunfuric làm xúc tác thì người ta thu được một chất lỏng không màu, mùi thơm, không tan trong nước và nổi trên mặt nước. Sản phẩm đó là
A. Metyl clorua.
B. Este.
C. Natri axetat
D. Etylen.
Câu 3: Chất nào sau đây làm quỳ tím đổi màu
A. CH3COOH
B. CH3CH2OH
C. CH2 = CH2
D. CH3OH
Câu 4: GIấm ăn là dung dịch axit axetic có nồng độ phần trăm từ:
A. 3-6%
B. 1-3%
C. 2-5%
D. 2-10%
4. Kết luận
Sau bài học cần nắm:
- Công thức phân tử, công thức cấu tạo, tính chất vật lý và tính chất hóa học của axit axetic.
- Biết nhóm -COOH là nhóm gây ra tính axit.
- Biết khái niệm este và phản ứng este hóa.
Tham khảo thêm
- doc Hoá học 9 Bài 44: Rượu etylic
- doc Hoá học 9 Bài 46: Mối liên hệ giữa etilen, rượu etylic và axit axetic
- doc Hoá học 9 Bài 47: Chất béo
- doc Hoá học 9 Bài 48: Luyện tập Rượu etylic, axit axetic và chất béo
- doc Hoá học 9 Bài 49: Thực hành: Tính chất của rượu và axit
- doc Hoá học 9 Bài 50: Glucozơ
- doc Hoá học 9 Bài 51: Saccarozơ
- doc Hoá học 9 Bài 52: Tinh bột và xenlulozơ
- doc Hoá học 9 Bài 53: Protein
- doc Hoá học 9 Bài 54: Polime
- doc Hoá học 9 Bài 55: Thực hành: Tính chất của gluxit
- doc Hoá học 9 Bài 56: Ôn tập cuối năm



