Hoá học 10 Bài 33: Axit sunfuric - Muối sunfat
Nội dung bài học Axit sunfuric - Muối sunfat tìm hiểu axit sunfuric đặc và loãng có những tính chất hóa học nào giống và khác những axit khác? Axit sunfuric có vai trò như thế nào đến nền kinh tế quốc dân? Phương pháp sản xuất axit sunfuric như thế nào?
Mục lục nội dung

1. Tóm tắt lý thuyết
Video 1: Giới thiệu về axitsunfuric
1.1. Axit sunfuric
a. Tính chất vật lí
Chất lỏng, sánh như dầu, không màu, không bay hơi.
Tan vô hạn trong nước và tỏa nhiều nhiệt.
Cách pha loãng axit sunfuric đặc: Rót từ từ axit đặc vào nước dọc theo đũa thủy tinh và khuấy đều. Tuyệt đối không làm ngược lại.
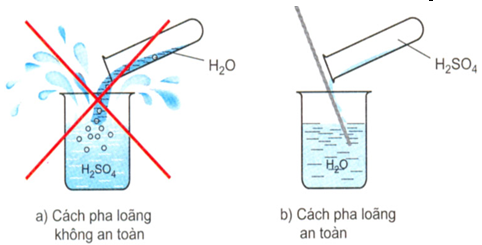
H2SO4 đặc khi tan vào nước sẽ tạo ra một lượng nhiệt rất lớn. Nếu đổ ngược lại sẽ làm nước sôi đột ngột kéo theo những giọt axit bắn ra xung quanh gây nguy hiểm. Nếu bắn vào quần áo sẽ làm cháy quần áo, bắn vào da sẽ gây bỏng axit.
b. Tính chất hoá học
Tính chất của dung dịch axit sunfuric loãng
Quỳ tím hoá đỏ
Tác dụng với kim loại đứng trước Hà muối + H2
Fe + H2SO4 → FeSO4 + H2
Tác dụng với bazơ và oxit bazơ → Muối + nước
Na2O + H2SO4 → Na2SO4 + H2O
2NaOH + H2SO4 → Na2SO4 + 2H2O
Tác dụng với muối của axit yếu hơn
Na2CO3 + H2SO4 → Na2SO4 + CO2 + H2O
Tính chất của axit sunfuric đặc
Tính oxi hoá mạnh
- Tác dụng với kim loại
H2SO4 đặc, nóng oxi hoá được hầu hết các kim loại (trừ Au, Pt)
M + H2SO4 → M2(SO4)n + {SO2, S, H2S } + H2O (n là hóa trị cao nhất của kim loại)
Ví dụ:
2H2SO4 + Cu → CuSO4 + SO2 + 2H2O
6H2SO4đ,n+2Fe → Fe2(SO4)3 + 3SO2 + 6H2O
Video 2: Thí nghiệm so sánh Cu khi phản ứng với H2SO4 đặc và loãng
Chú ý: Al,Cr, Fe thụ động hóa trong H2SO4 đặc nguội.
Thụ động hóa nghĩa là kim loại sau khi nhúng vào dung dịch H2SO4 đặc nguội, lấy ra thì không còn khả năng phản ứng với axit loãng , dung dịch muối mà bình thường nó có phản ứng.
- Tác dụng với phi kim có tính khử
H2SO4 đặc, nóng tác dụng được với các phi kim có tính khử tạo hợp chất của phi kim có số oxi hóa cao nhất (trừ S) như C,P, …
2H2SO4 + C → CO2 + 2SO2 + 2H2O
2H2SO4 + S → 3SO2 + 2H2O
Video 3: Phản ứng giữa bột lưu huỳnh và axit sunfuric đặc
- Tác dụng với hợp chất
H2SO4 đặc, nóng còn tác dụng được với các hợp chất có tính khử như H2S, FeO, KBr, HI, …
3H2SO4 + H2S → 4SO2 + 4H2O
2H2SO4 + KBr → Br2 + SO2 + 2H2O + K2SO4
Tính háo nước
H2SO4đặc lấy nước từ các hợp chất hữu cơ làm hoá than các hợp chất gluxit ví dụ glucozơ, saccarozơ, tinh bột và xenlulozơ.
Cn(H2O)m → nC + mH2O
(gluxit)
Phản ứng của axit sunfuric với đường:
Video 4: Axit sunfuric tác dụng với đường
Phương trình: C12H22O11 → 12C + 11H2O
Một phần Cacbon bị H2SO4 đặc oxi hóa thành khí CO2 cùng SO2 bay lên làm sủi bọt, đẩy Cacbon trào ra ngoài cốc.
C + 2H2SO4 → 2CO2 + SO2 + 2H2O
- GV có thể làm thí nghiệm dùng đũa thuỷ tinh chấm H2SO4 đặc viết lên tờ giấy (nét chữ sẽ hoá đen) hoặc viết bằng dung dịch H2SO4 loãng rồi hơ tờ giấy lên ngọn lửa đèn cồn cho học sinh quan sát.
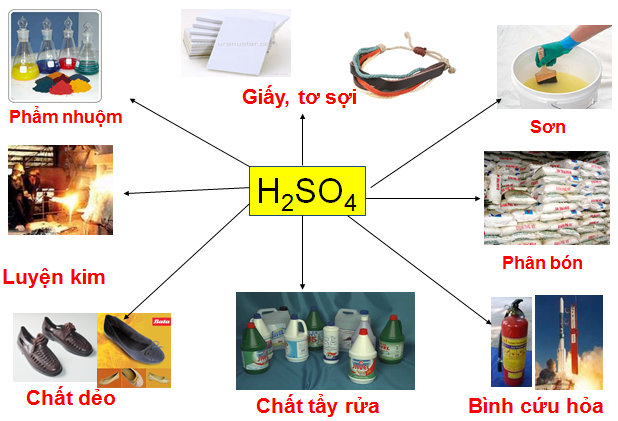
c. Ứng dụng
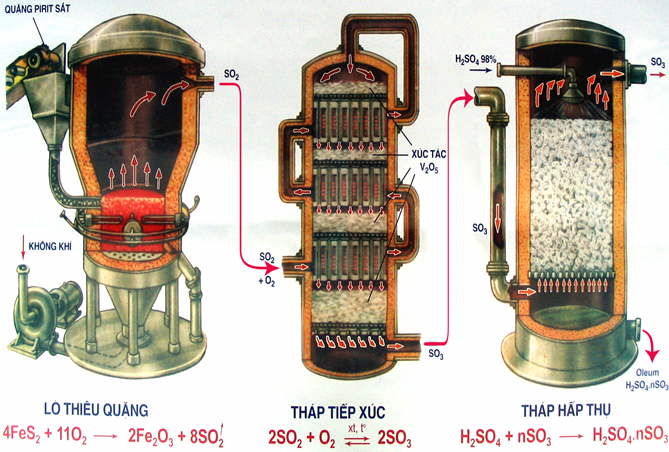
d. Sản xuất axit sunfuric
- Axit sunfuric được sản xuất trong công nghiệp bằng phương pháp tiếp xúc.
- Phương pháp gồm 3 công đoạn chính.
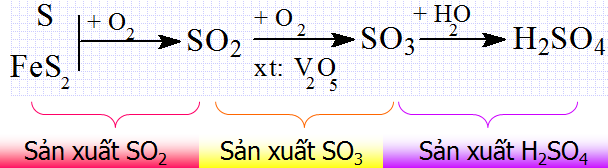
Sản xuất SO2
- Phụ thuộc vào nguồn nguyên liệu có sẵn, người ta đi từ nguyên liệu ban đầu là lưu huỳnh hoặc pirit sắt FeS2...
- Đốt cháy lưu huỳnh: S + O2 → SO2
- Đốt quặng pirit sắt: 4FeS2 + 11O2 → 2SO2 + 8Fe2O3
Sản xuất SO3
Oxi hóa SO2 bằng khí Oxi hoặc không khí dư ở nhiệt độ 450 - 500oC, chất xúc tác là V2O5 (vanadi pentoxit)
SO2 + O2 → SO3
Hấp thụ SO3 bằng H2SO4
- Người ta hấp thụ SO3 bằng phương pháp ngược dòng. Trong tháp hấp thụ, cho khí SO3 đi từ dưới lên, H2SO4 tưới từ trên xuống để tạo được diện tích tiếp xúc tối đa, hiệu suất hấp thụ đạt cao nhất.
- Chú ý: không dùng H2O để hấp thụ SO3 vì phản ứng xảy ra rất mãnh liệt, H2SO4 thu được ở dạng hơi nên rất khó vận chuyển.
nSO3 + H2SO4 → H2SO4.n SO3
oleum
H2SO4.n SO3 + nH2O → (n+1) H2SO4
1.2. Muối sunfat. Nhận biết muối sunfat
a. Muối sunfat
- Muối trung hòa chứa gốc SO42-: Na2SO4, CaSO4, … ( hầu hết đều tan trừ BaSO4, SrSO4, PbSO4 không tan và CaSO4, Ag2SO4 ít tan.
- Muối axit chứa gốc HSO4-: NaHSO4, Ca(HSO4)2, … (các muối axit đều tan)
b. Nhận biết muối sunfat
Thuốc thử: dd muối của kim loại Ba, dd Ba(OH)2.
Hiện tượng: có kết tủa trắng, không tan trong axit BaSO4
Ví dụ: Na2SO4 + Ba(OH)2 → BaSO4 + 2NaOH
Video 5: Nhận biết muối sunfat
2. Bài tập minh họa
2.1. Dạng 1: Lý thuyết về axit sunfuric, muối sunfua
Bài 1: Cách pha loãng H2SO4 đặc an toàn là :
A. Rót nhanh axit vào nước và khuấy đều.
B. Rót nhanh nước vào axit và khuấy đều.
C. Rót từ từ nước vào axit và khuấy đều.
D. Rót từ từ axit vào nước và khuấy đều.
Hướng dẫn giải
Cách pha loãng H2SO4 đặc an toàn là tót từ từ axit vào nước, khuấy đều và không làm ngược lại
Đáp án D
Bài 2: Cho bột Fe vào dung dịch H2SO4 đặc, nóng cho đến khi Fe không còn tan được nữa. Sản phẩm thu được trong dung dịch sau phản ứng là
A. FeSO4.
B. Fe2(SO4)3.
C. FeSO4 và Fe.
D. FeSO4 và Fe2(SO4)3.
Hướng dẫn giải
Sau phản ứng Fe còn dư chưa tan hết
→ Muối sinh ra là FeSO4
Đáp án A.
Bài 3: Cho sơ đồ phản ứng:
H2SO4 đặc, nóng + Fe → Fe2(SO4)3 + H2O + SO2
Số phân tử H2SO4 bị khử và số phân tử H2SO4 trong PTHH của phản ứng trên là:
A. 6 và 3
B. 3 và 6
C. 6 và 6
D. 3 và 3.
Hướng dẫn giải
Ta có cân bằng phương trình:
6H2SO4 đặc, nóng + Fe → Fe2(SO4)3 + 6H2O + 3SO2
→ Số phân tử H2SO4 bị khử là 3, và số phân tử H2SO4 có trong phương trình là 6
Đáp án B
2.2. Dạng 2: Kim loại, hợp chất tác dụng với H2SO4 loãng
Bài 1: Cho 3,68 gam hỗn hợp gồm Al và Zn tác dụng với một lượng vừa đủ dung dịch H2SO4 10% thu được 2,24 lít khí H2 (ở đktc).
Khối lượng dung dịch thu được sau phản ứng là?
Khối lượng mỗi kim loại trong hỗn hợp.
A. 101,48g
B. 101,68g
C. 97,80g
D. 88,20g
Hướng dẫn giải
Gọi số mol của Al, Zn lần lượt là a, b mol
Tổng khối lượng kim loại bằng 3,68 gam
→ 27a + 65b = 3,68 (I)
Ta có phương trình hóa học:
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
a 3/2 a 3/2a
Zn + H2SO4 → ZnSO4 + H2
b b b
nH2 = 2,24 : 22,4 = 0,1 mol
nH2SO4 = nH2 = 0,1 mol
→ m H2SO4 = 0,1.98 = 9,8 gam
m dd H2SO4 = m ct : C% = 9,8 : 10% = 98
Áp dung định luật bảo toàn khối lượng
→ mKL + m dd H2SO4 = m dd lúc sau + mH2
→ m dd lúc sau = 3,68 + 98 – 0,1 * 2 = 101,48 gam
→ 3/2 a + b = 0,1 (II)
Từ (I) và (II) → a = 0,04 mol ; b = 0,04 mol
mAl = 0,04.27 = 1,08 gam
mZn = 0,04.65 = 2,6 gam
Bài 2: Để hoà tan hoàn toàn 2,32 gam hỗn hợp gồm FeO, Fe3O4 và Fe2O3 (trong đó số mol FeO bằng số mol Fe2O3) cần dùng vừa đủ V lít dung dịch H2SO4 0,5M loãng. Giá trị của V là:
A. 0,23.
B. 0,18.
C. 0,08.
D. 0,16.
Hướng dẫn giải
Theo đề bài n FeO = n Fe2O3
→ Coi như hỗn hợp trên chỉ gồm có Fe3O4
nFe3O4 = 2,32 : 232 = 0,01 mol
Ta có phương trình:
Fe3O4 + 4H2SO4 → FeSO4 + Fe2(SO4)3 + 4H2O
0,01 0,04
→ nH2SO4 = 0,04 mol
V H2SO4 = n : CM = 0,04 : 0,5 = 0,2M
2.3. Dạng 3: Bài toán về H2SO4 đặc
Bài 1: Cho 12,8 gam Cu tác dụng với H2SO4 đặc nóng dư, khí sinh ra cho vào 200 ml dung dịch NaOH 2M. Hỏi muối nào được tạo thành và khối lượng là bao nhiêu gam ?
A. Na2SO3 và 24,2 gam.
B. Na2SO3 và 25,2 gam.
C. NaHSO3 15 gam và Na2SO3 26,2 gam.
D. Na2SO3 và23,2 gam.
Hướng dẫn giải
n Cu = 12,8 : 64 = 0,2 mol
Ta có phương trình phản ứng:
Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O (I)
Từ (I) → nSO2 = nCu = 0,2 (mol)
n NaOH = 0,2.2 = 0,4 mol
Xét T = n OH/ n SO2 = 0,4 : 0,2 = 2
→ Muối Na2SO3 được tạo thành.
Ta có phương trình:
SO2 + 2NaOH → Na2SO3 + H2O
0,2 0,2
→ Khối lượng muối tạo thành sau phản ứng là:
0,2.106 = 21,2 gam
Bài 2: Khi cho 9,6 gam Mg tác dụng hết với dung dịch H2SO4 đậm đặc, thấy có 49 gam H2SO4 tham gia phản ứng, tạo muối MgSO4, H2O và sản phẩm khử X. X là:
A. SO2.
B. S.
C. H2S.
D. SO2, H2S.
Hướng dẫn giải
n Mg = 9,6 : 24 = 0,4 mol
Ta có:
Mg + H2SO4 → MgSO4 + sản phẩm khử + H2O
n H2SO4 phản ứng = 49 : 98 = 0,5 (mol)
Áp dụng định luật bảo toàn nguyên tố lưu huỳnh:
n H2SO4 = n MgSO4 + n S có trong sản phẩm khử
→ nS có trong sản phẩm khử = 0,5 – 0,4 = 0,1 mol
Ta có quá trình nhường nhận e như sau:
Mg → Mg+2 + 2e
0,4 0,8
S+6 + xe → X
0,8 0,1
→ x = 0,8 : 0,1 = 8
→ 1 mol S+6 khi nhận về 8 mol e để sinh ra H2S.
Khí sinh ra là khí H2S
Đáp án C.
3. Luyện tập
3.1. Bài tập tự luận
Câu 1: Hòa tan hoàn toàn 2,81 gam hỗn hợp gồm Fe2O3, MgO, ZnO trong 500 ml axit H2SO4 0,1M (vừa đủ). Sau phản ứng cô cạn dung dịch hỗn hợp muối sunfat khan thu được có khối lượng là?
Câu 2: Cho hỗn hợp gồm 1 mol chất X và 1 mol chất Y tác dụng hết với dung dịch H2SO4 đăc, nóng (dư) tạo ra 1 mol khí SO2 (sản phẩm khử duy nhất). Hai chất X, Y là?
Câu 3: Hòa tan hoàn toàn 5,5 gam hỗn hợp gồm Al và Fe vào lượng dư dung dịch H2SO4 loãng, thu được 4,48 lít H2 (đktc). Thành phần phần trăm khối lượng của Fe trong hỗn hợp đầu là?
Câu 4: Cho m gam hỗn hợp X gồm Al, Cu vào dung dịch H2SO4 loãng (dư), thu được 6,72 lít khí (đktc). Nếu cho m gam hỗn hợp X trên vào một lượng dư dung dịch H2SO4 (đặc, nguội), thu được 6,72 lít khí SO2 (sản phẩm khử duy nhất, ở đktc). Giá trị của m là?
Câu 5: Hòa tan hoàn toàn 3,22 gam hỗn hợp X gồm Fe, Mg và Zn bằng 1 lượng vừa đủ dung dịch H2SO4 loãng, thu được 1,344 lít khí hidro (đktc) và dung dịch chứa m gam muối. Giá trị của m là?
3.2. Bài tập trắc nghiệm
Câu 1: Dãy kim loại nào trong các dãy sau đây gồm các kim loại đều không tác dụng với dung dịch H2SO4 loãng?
A. Al, Mg, Cu
B. Fe, Mg, Ag
C. Al, Fe, Mg
D. Al, Fe, Cu
Câu 2: Dãy kim loại nào trong các dãy sau đây gồm các kim loại đều không tác dụng với dung dịch H2SO4 đặc, nguội?
A. Al, Fe, Au, Mg
B. Zn, Pt, Au, Mg
C. Al, Fe, Zn, Mg
D. Al, Fe, Au, Pt
Câu 3: Cho phương trình hóa học:
aAl + bH2SO4 → cAl2(SO4)3 + dSO2 + e H2O
Tỉ lệ a:b là
A. 1:1
B. 2:3
C. 1:3
D. 1:2
Câu 4: Trong điều kiện thích hợp, có thể xảy ra các phản ứng sau:
H2SO4 + C → 2SO2 + CO2 + 2H2O
H2SO4 + Fe(OH)2 → FeSO4 + 2H2O
4H2SO4 +2FeO → Fe2(SO4)3 + SO2 + 4H2O
6H2SO4 + 2Fe → Fe2(SO4)3 + 3SO2 + 6H2O
Trong các phản ứng trên, khi dung dịch H2SO4 là dung dịch loãng thì phản ứng nào có thể xảy ra?
A. (a)
B. (c)
C. (b)
D. (d)
Câu 5: Cho 0,015 mol một loại hợp chất oleum vào nước thu được 200ml dung dịch X. Để trung hòa 100 ml dung dịch X cần dùng 200 ml dung dịch NaOH 0,15M. Thành phần phần trăm về khối lượng của nguyên tố lưu huỳnh trong oelum trên là
A. 37,86%
B. 35,96%
C. 23,97%
D. 32,655%
3.3. Trắc nghiệm Online
Các em hãy luyện tập bài trắc nghiệm Axit sunfuric - Muối sunfat Hóa học 10 sau để nắm rõ thêm kiến thức bài học.
4. Kết luận
Sau bài học cần nắm:
- Tính chất vật lí của H2SO4. Cách pha loãng axit H2SO4 đặc.
- Dung dịch H2SO4 loãng có đầy đủ tính chất của một axit. Axit H2SO4 đặc có tính oxi hóa mạnh.
- H2SO4 loãng là axit mạnh (đổi màu chất chỉ thị, tác dụng với kim loại, bazơ, oxit bazơ và muối của axit yếu hơn…).
- H2SO4 đặc, nóng có tính oxi hoá mạnh gây ra bởi gốc SO42- trong đó S có số oxi hóa cao nhất +6.
Tham khảo thêm
- doc Hoá học 10 Bài 29: Oxi - Ozon
- doc Hoá học 10 Bài 30: Lưu huỳnh
- doc Hoá học 10 Bài 31: Bài thực hành số 4 Tính chất của oxi, lưu huỳnh
- doc Hoá học 10 Bài 32: Hiđro sunfua - Lưu huỳnh đioxit - Lưu huỳnh trioxit
- doc Hoá học 10 Bài 34: Luyện tập Oxi và lưu huỳnh
- doc Hoá học 10 Bài 35: Bài thực hành số 5 Tính chất các hợp chất của lưu huỳnh



