Hóa học 12 Bài 29: Luyện tập Tính chất của nhôm và hợp chất của nhôm
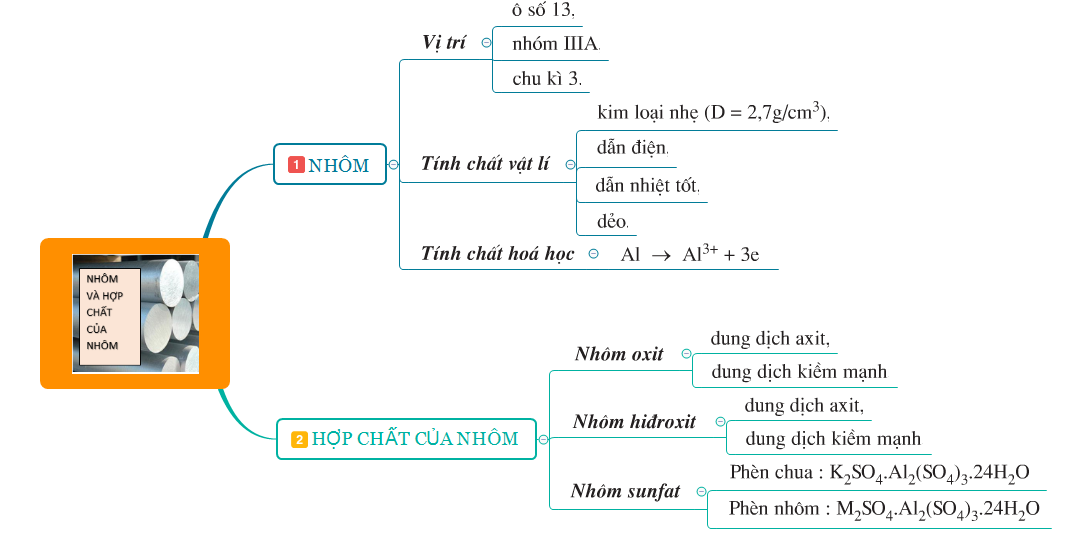
Dựa theo cấu trúc SGK hóa học 12, eLib xin chia sẻ với các bạn nội dung bài luyện tập Tính chất của Nhôm và hợp chất của nhôm là bài tổng ôn, củng cố các kiến thức đã học về Nhôm và các hợp chất như Al2O3 (Nhôm oxit), Al(OH)3 (Nhôm hidroxit), Al2(SO4)
Mục lục nội dung

1. Tóm tắt lý thuyết
2. Bài tập minh họa
2.1. Dạng 1: Bài tập chuỗi phản ứng
Bài 1: Viết phương trình hóa học biểu diễn những chuyển đổi hóa học sau:
Al → Al2O3 → AlCl3 → Al(OH)3 → Ba(Al(OH)4)2
Al2O3 → Na(Al(OH)4) → Al(OH)3
Hướng dẫn giải
(1) 4Al + 3O2 → 2Al2O3
(2) Al2O3 + 6HCl → 2AlCl3 + 3H2O
(3) AlCl3 + 3NH3 + 3H2O → Al(OH)3 + 3NH4Cl
(4) 2Al(OH)3 + Ba(OH)2 → Ba(Al(OH)4)2
(5) Al2O3 + 2NaOH + 3H2O → 2Na(Al(OH)4)
(6) Na(Al(OH)4) + CO2 → NaHCO3 + Al(OH)3
2.2. Dạng 2: Bài tập Phản ứng nhiệt nhôm
Bài 1: Trộn 0,81 gam bột Al với bột Fe2O3 và CuO rồi nung nóng để tiến hành phản ứng nhiệt nhôm, thu được hỗn hợp X. Hòa tan X trong dung dịch HNO3 loãng, nóng, thu được V lit khí NO (đktc). Giá trị của V là:
A. 0,224 lit
B. 2,24 lit.
C. 6,72 lit
D. 0,672 lit
Hướng dẫn giải
Ta có: nA1 = 0,03 (mol)
Các phương trình phản ứng:
2Al + Fe2O3 → Al2O3 + 2Fe (1)
2Al + 3CuO → Al2O3 + 3Cu (2)
Gọi số mol Al tham gia phản ứng (1) là x, tham gia phản ứng (2) là y.
Theo (1): nFe = nAl = x (mol)
Theo (2): nCu = 3/2 nAl = 3/2y (mol)
Fe + 4HNO3 loãng → Fe(NO3)3 + NO + 2H2O (3)
3Cu + 8HNO3 loãng → 3Cu(NO3)2 + 2NO + 4H2O (4)
Theo (3): nNO/(3) = nFe = x (mol).
Theo (4): nNO/(4) = 2/3 .nCu = 2/3 .x. 3/2 .x .y = y(mol)
⇒ nNO = x + y = 0,03 (mol) ⇒ VNO = 0,03 x 22,4 = 0,672 (lit).
2.3. Dạng 3: Bài tập về tính lưỡng tính của nhôm
Bài 1: Cho m gam hỗn hợp bột Al và Fe tác dụng với dung dịch NaOH dư thấy thoát ra 6,72 lít khí (đktc). Nếu cho m gam hỗn hợp trên tác dụng với dung dịch HCl dư thì thấy thoát ra 8,96 lít khí (đktc). Tính khối lượng của Al và Fe trong hỗn hợp ban đầu?
Hướng dẫn giải
Ta có: nH2(1) = 6,72/22,4 = 0,3(mol)
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2 (1)
0,2 0,3
Từ (1) ⇒ nAl = 0,2(mol) ⇒ mAl = 0,2*27 = 5,4 (gam)
Mà nH2(2)(3) = 8,96/22,4 = 0,4(mol)
2Al + 6HCl → 2AlCl3 + 3H2 (2)
0,2 0,3
Fe + 2HCl → FeCl2 + H2 (3)
0,1 0,1
Từ (2) và (3) suy ra: mFe = 0,1*56 = 5,6(gam)
Bài 2: Cho 0,5 lít dung dịch NaOH tác dụng với 300ml dung dịch Al2(SO4)3 0,2M thu được 1,56g kết tủa. Tính nồng độ mol/lít của dung dịch NaOH. Biết các phản ứng xảy ra hoàn toàn?
Hướng dẫn giải
Số mol Al3+ = 0,12 mol.
Số mol Al(OH)2 = 0,02 mol < số mol Al3+ nên có 2 trường hợp xảy ra.
+ TH1: Al3+ dư → Chỉ tạo Al(OH)3 nên số mol OH- = 3 . 0,02 = 0,06 mol.
→ CM(NaOH) = 0,12M
+ TH2: Al3+ hết → tạo
Al(OH)3 : 0,02 mol
[Al(OH)4]- : 0,12 – 0,02 = 0,1 mol
→ Số mol OH- = 3 . 0,02 + 4 . 0,1 = 0,46 mol
→ CM(NaOH) = 0,92M
3. Luyện tập
3.1. Bài tập tự luận
Câu 1: Có 3 chất rắn là: Mg, Al, Al2O3. Hãy nhận biết mỗi chất đã cho bằng phương pháp hóa học. Viết các phương trình hóa học.
Câu 2: Cho 100 ml dung dịch hỗn hợp Al2(SO4)3 1M và CuSO4 1M tác dụng với dung dịch NaOH dư. Kết tủa thu được đem nung đến khối lượng không đổi thu được chất rắn có khối lượng là?
Câu 3: Hoà tan hoàn toàn 47,4 gam phèn chua KAl(SO4)2.12H2O vào nước, thu được dung dịch X. Cho toàn bộ X tác dụng với 200 ml dung dịch Ba(OH)2 1M, sau phản ứng thu được m gam kết tủa. Giá trị của m là?
Câu 4: Dung dịch A là dung dịch NaOH. Lấy 100 ml dung dịch A trộn với 400 ml dung dịch AlCl3 0,1M thì lượng kết tủa sinh ra bằng với lượng kết tủa khi lấy 500 ml dung dịch A trộn với 400 ml dung dịch AlCl3 0,1M. Giá trị CM dung dịch NaOH là?
3.2. Bài tập trắc nghiệm
Câu 1: Cho V lít dung dịch NaOH 0,4M tác dụng với 58,14g Al2(SO4)3 thu được 23,4g kết tủa. Tìm giá trị lớn nhất của V?
A. 2,65 lít
B. 2,24 lít
C. 1,12 lít
D. 3,2 lít
Câu 2: Cho 150 cm3 dung dịch NaOH 7M tác dụng với 100cm3 dung dịch Al2(SO4)3 1M. Hãy xác định nồng độ mol của NaOH trong dung dịch sau phản ứng:
A. 0,8M
B. 1,2M
C. 1M
D. 0,75M
Câu 3: Cho từ từ 0,7 mol NaOH vào dung dịch chứa 0,1 mol Al2(SO4)3. Số mol kết tủa thu được là:
A. 0,2
B. 0,15
C. 0,1
D. 0,05
Câu 4: Đốt nóng hỗn hợp X gồm Fe2O3 và bột Al trong môi trường không có không khí. Nếu cho những chất còn lại sau phản ứng tác dụng với dung dịch NaOH dư sẽ thu được 0,3 mol H2; còn nếu cho tác dụng với dung dịch HCl dư thu được 0,4 mol H2. Vậy số mol Al trong hỗn hợp X là:
A. 0,3
B. 0,4
C. 0,25
D. 0,6
Câu 5: Hỗn hợp X gồm Fe2O3 và Al có tỉ lệ mol tương ứng là 1:3. Thực hiện phản ứng nhiệt nhôm X (không có không khí) đến khi phản ứng xảy ra hoàn toàn thu được hỗn hợp gồm:
A. Al2O3 và Fe
B. Al, Fe và Al2O3
C. Al, Fe, Fe3O4 và Al2O3
D. Al2O3, Fe và Fe3O4
3.3. Trắc nghiệm Online
Các em hãy luyện tập bài trắc nghiệm Luyện tập Tính chất của nhôm và hợp chất của nhôm Hóa học 12 sau để nắm rõ thêm kiến thức bài học.
4. Kết luận
Sau bài học cần nắm:
- Nhôm và các hợp chất như Al2O3 (Nhôm oxit), Al(OH)3 (Nhôm hidroxit), Al2(SO4)3 (Nhôm sunfat) ....
- Kĩ năng giải các bài tập và các dạng toán quan trọng.
Tham khảo thêm
- pdf Hóa học 12 Bài 25: Kim loại kiềm và hợp chất quan trọng của kim loại kiềm
- docx Hóa học 12 Bài 26: Kim loại kiềm thổ và hợp chất quan trọng của chúng
- docx Hóa học 12 Bài 27: Nhôm và hợp chất của Nhôm
- docx Hóa học 12 Bài 28: Luyện tập Tính chất của kim loại kiềm, kim loại kiềm thổ và hợp chất của chúng
- docx Hóa học 12 Bài 30: Thực hành Tính chất của natri, magie, nhôm và hợp chất của chúng