Hóa học 12 Bài 20: Sự ăn mòn kim loại
Bài học này trình bày nội dung: Sự ăn mòn kim loại. Dãy điện hóa của kim loại. Dựa vào cấu trúc SGK hóa học lớp 12, eLib sẽ tóm tắt lại hệ thống lý thuyết và hướng dẫn giải các bài tập 1 cách chi tiết, dễ hiểu. Hi vọng rằng, đây sẽ là tài liệu hữu ích giúp các em học tập tốt hơn.
Mục lục nội dung

1. Tóm tắt lý thuyết
1.1. Khái niệm về Ăn mòn kim loại
- Sự ăn mòn kim loại là sự phá huỷ kim loại hoặc hợp kim do tác dụng của các chất trong môi trường xung quanh
- Kim loại bị oxi hoá thành ion dương: M → Mn+ + ne
1.2. Các dạng ăn mòn
a. Ăn mòn hóa học.
Ví dụ: Cổng sắt bị rỉ sét do ăn mòn hóa học:
3Fe + 2O2 → Fe3O4
3Fe + 2H2O → Fe3O4 + 2H2

⇒ Ăn mòn hoá học là quá trình oxi hoá – khử, trong đó các electron của kim loại được chuyển trực tiếp đến các chất trong môi trường.
b. Ăn mòn điện hóa học
- Thí nghiệm: Ăn mòn điện hóa với 2 điện cực là Zn và Cu
- Giải thích hiện tượng:
+ Điện cực âm (anot); Zn bị ăn mòn theo phản ứng: Zn → Zn2+ + 2e. Ion Zn2+ đi vào dung dịch, các electron theo dây dẫn sang điện cực Cu.
+ Điện cực dương (catot): ion H+ của dung dịch H2SO4 nhận electron biến thành nguyên tử H rồi thành phân tử H2 thoát ra. 2H+ + 2e → H2
- Ăn mòn điện hoá là quá trình oxi hoá – khử, trong đó kim loại bị ăn mòn do tác dụng của dung dịch chất điện li và tạo nên dòng electron chuyển dời từ cực âm đến cực dương.
- Ăn mòn điện hoá học hợp kim sắt trong không khí ẩm
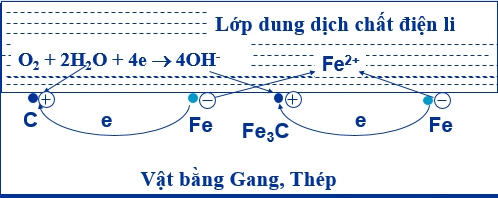
- Tại anot: Fe → Fe2+ + 2e; Tại catot: O2 + 2H2O + 4e → 4OH-
- Điều kiện để xảy ra ăn mòn điện hóa học
+ Các điện cực phải khác nhau về bản chất. Cặp KL – KL; KL – PK; KL – Hợp chất hoá học
+ Các điện cực phải tiếp xúc trực tiếp hoặc gián tiếp qua dây dẫn.
+ Các điện cực cùng tiếp xúc với một dung dịch chất điện li.
1.3. Chống ăn mòn kim loại
a. Phương pháp bảo vệ bề mặt
- Dùng những chất bền vững với môi trường để phủ mặt ngoài những đồ vật bằng kim loại như bôi dầu mỡ, sơn, mạ, tráng men,…
- Ví dụ: Mạ tượng, sơn phủ bên ngoài đồ vật,...


b. Phương pháp điện hóa
- Nối kim loại cần bảo vệ với một kim loại hoạt động hơn để tạo thành pin điện hoá và kim loại hoạt động hơn sẽ bị ăn mòn, kim loại kia được bảo vệ.
- Ví dụ: Bảo vệ vỏ tàu biển làm bằng thép bằng cách gán vào mặt ngoài của vỏ tàu (phần chìm dưới nước) những khối Zn, kết quả là Zn bị nước biển ăn mòn thay cho thép.
2. Bài tập minh họa
2.1. Dạng 1: Xác định kim loại bị ăn mòn
Cho các hợp kim sau: Cu-Fe (I); Zn-Fe (II); Fe-C (III); Sn-Fe (IV). Khi tiếp xúc với dung dịch chất điện li thì các hợp kim mà trong đó Fe đều bị ăn mòn trước là?
Hướng dẫn giải
- Trong cặp điện cực: kim loại – kim loại thì kim loại nào có tính khử mạnh hơn đóng vai trò là cực âm (anot) thì kim loại đó bị ăn mòn khi tiếp xúc với dung dịch chất điện li. (Mẹo: Dựa vào dãy điện hóa của kim loại. .Cái nào càng mạnh thì càng bị ăn mòn. Ví dụ như cặp Cu - Fe. Fe là kim loại mạnh hơn Cu nên Fe bị ăn mòn)
- Trong cặp điện cực: kim loại – phi kim thường hay gặp nhất là Fe – C thì kim loại đóng vai trò là cực âm và bị ăn mòn khi tiếp xúc với dung dịch chất điện li.
- Do vậy các cặp hợp kim thỏa mãn là: I, III, IV.
2.2. Dạng 2: Xác định số trường hợp bị ăn mòn
Bài 1: Có 4 dung dịch riêng biệt: CuSO4, ZnCl2, FeCl3, AgNO3. Nhúng vào mỗi dung dịch một thanh Ni. Số trường hợp xuất hiện ăn mòn điện hoá là?
Hướng dẫn giải
Ăn mòn điện hóa
Điều kiện: 2 kim loại, kim loại - phi kim (gang, thép)
\(\begin{array}{l}
Ni + C{u^{2 + }} \to N{i^{2 + }} + Cu\\
Ni + F{e^{3 + }} \to N{i^{2 + }} + F{e^{2 + }}\\
Ni + A{g^ + } \to N{i^{2 + }} + Ag
\end{array}\)
Vậy số trường ăn mòn điện hóa là 2.
Bài 2: Nhúng thanh kim loại Fe vào các dung dịch sau: FeCl3; CuCl2; H2SO4 (loãng) + CuSO4; H2SO4 loãng; AgNO3. Số trường hợp thanh kim loại sắt tan theo cơ chế ăn mòn điện hóa là?
Hướng dẫn giải
CuCl2; H2SO4 loãng + CuSO4; AgNO3
2.3. Dạng 3: Xác định lượng chất sau phản ứng
Bài 1: Cho hỗn hợp X gồm 0,56 gam Fe và Mg tác dụng với 250 ml dung dịch CuSO4. Sau khi các phản ứng xảy ra hoàn toàn, thu được 0,92 gam kim loại. Nồng độ mol/l của dung dịch CuSO4 là:
Hướng dẫn giải
Sử dụng phương pháp tăng giảm khối lượng:
\({n_{Mg}}.\Delta {M_{Cu - Mg}} + {n_{Fe(p/u)}}.\Delta {M_{Cu - Fe}}\)
= m rắn - m Fe, Mg(ban đầu)
→ 0,005.40 + 8x = 0,24 → x = 0,005
Bảo toàn electron:
nCuSO4 = nMg + nFe(p/u) = 0,01 mol ⇒ CM = 0,04 M
Bài 2: Cho một thanh sắt có khối lượng m gam vào dung dịch chứa 0,012 mol AgNO3 và 0,02 mol Cu(NO3)2, sau một thời gian khối lượng của thanh sắt là (m + 1,04) gam. Tính khối lượng của kim loại bám trên thanh sắt?
Hướng dẫn giải
Fe + 2Ag+ → Fe2+ + 2Ag
Fe + Cu2+ → Fe2+ + Cu
Nếu chỉ có Ag phản ứng ⇒ mKL tăng = 0,012.108 - 0,006.56 = 0,96 g < 1,04 g
Có x mol Cu2+ phản ứng
⇒ mKL tăng = 1,04 = (0,012.108 + 64x) - (0,006 + x).56
⇒ x = 0,01 mol
⇒ mKL bám = mAg + mCu = 1,936
3. Luyện tập
3.1. Bài tập tự luận
Câu 1: Nhúng một thanh Mg vào dung dịch có chứa 0,8 mol Fe(NO3)3 và 0,05 mol Cu(NO3)2. Sau một thời gian, lấy thanh kim loại ra, rửa sạch, cân lại thấy khối lượng tăng 11,6 gam so với thanh kim loại ban đầu. Khối lượng Mg đã phản ứng là?
Câu 2: Cho 2,7 gam hỗn hợp bột X gồm Fe và Zn tác dụng với dung dịch CuSO4. Sau một thời gian, thu được dung dịch Y và 2,84 gam chất rắn Z. Cho toàn bộ Z vào dung dịch H2SO4 loãng dư, sau khi các phản ứng kết thúc thì khối lượng chất rắn giảm 0,28 gam và dung dịch thu được chỉ chứa một muối duy nhất. Phần trăm khối lượng của Fe trong X là?
3.2. Bài tập trắc nghiệm
Câu 1: Cho các phát biểu sau đây về ăn mòn hoá học :
(1) Ăn mòn hoá học không làm phát sinh dòng điện một chiều.
(2) Kim loại tinh khiết không bị ăn mòn hoá học.
(3) Về bản chất, ăn mòn hoá học cũng là một dạng của ăn mòn điện hoá.
(4) Ăn mòn hoá học là quá trình oxi hoá-khử.
Trong các phát biểu trên, số phát biểu đúng là
A. 1.
B.2.
C. 3.
D. 4.
Câu 2: Trường hợp nào sau đây là ăn mòn điện hoá ?
A. Thép bị gỉ trong không khí ẩm.
B. Nhôm bị thụ động hoá trong HNO3 đặc nguội,
C. Zn bị phá huỷ trong khí Cl2.
D. Na cháy trong không khí ẩm.
Câu 3: Cuốn một sợi dây thép xung quanh một thanh kim loại rồi nhúng vào dung dịch H2SO4 loãng. Quan sát thấy bọt khí thoát ra rất nhanh từ sợi dây thép. Thanh kim loại đã dùng có thể là
A.Cu.
B.Ni.
C.Zn.
D. Pt.
Câu 4: Ngâm một lá Zn vào dung dịch HC1 thấy bọt khí thoát ra ít và chậm. Nếu nhỏ thêm vài giọt dung dịch X thì thấy bọt khí thoát ra rất nhiều và nhanh. Chất tan trong dung dịch X là chất nào sau đây?
A. H2SO4
B. MgSO4
C. NaOH
D. CuSO4
Câu 5: Cho các cặp kim loạị nguyên chất tiếp xúc trực tiếp với nhau : Fe và Pb; Fe và Zn ; Fe và Sn ; Fe và Ni. Khi nhúng các cặp kim loại trên vào dung dịch axit, số cặp kim loại trong đó Fe bị phá hủy trước là
A. 1.
B. 2.
C. 3.
D. 4.
3.3. Trắc nghiệm Online
Các em hãy luyện tập bài trắc nghiệm Sự ăn mòn kim loại Hóa học 12 sau để nắm rõ thêm kiến thức bài học.
4. Kết luận
Qua nội dung bài học này để nắm được toàn bộ kiến thức nội dung bài học các bạn cần nắm các nội dung chính sau đây, bên cạnh đó là lời giải các bài tập trong sách giáo khoa.
- Ăn mòn là gì?
- Các dạng ăn mòn kim loại gồm những loại nào?
- Biện pháp chống ăn mòn.
Tham khảo thêm
- docx Hóa 12 Bài 17: Vị trí của kim loại trong BTH và cấu tạo của kim loại
- docx Hóa học 12 Bài 18: Tính chất của kim loại và dãy điện hóa của kim loại
- docx Hóa học 12 Bài 19: Hợp kim
- docx Hóa học 12 Bài 21: Điều chế kim loại
- docx Hóa học 12 Bài 22: Luyện tập Tính chất của kim loại
- docx Hóa học 12 Bài 23: Luyện tập Điều chế kim loại và sự ăn mòn kim loại
- docx Hóa học 12 Bài 24: Thực hành Tính chất, điều chế kim loại, sự ăn mòn kim loại



