Hoá học 10 Bài 13: Liên kết cộng hóa trị
Chúng ta đã biết một loại liên kết hóa học được hình thành bằng lực hút tĩnh điện giữa các ion trái dấu, hôm nay chúng ta sẽ nghiên cứu loại liên kết được hình thành do sự góp chung electron để dùng chung. Đó là liên kết cộng hóa trị.
Mục lục nội dung

1. Tóm tắt lý thuyết
1.1. Sự hình thành liên kết cộng hóa trị
a. Liên kết cộng hóa trị hình thành giữa các nguyên tử giống nhau. Sự hình thành đơn chất.
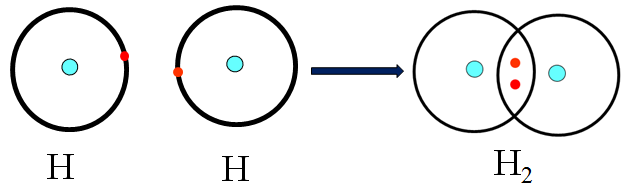
Sự hình thành phân tử H2
Hai nguyên tử H góp 1 electron tạo thành một cặp electron chung trong phân tử H2.
Công thức H:H được gọi là công thức electron.
Công thức H-H gọi là công thức cấu tạo.
Sự hình thành phân tử nitơ
Mỗi nguyên tử N góp chung 3e để tạo thành 3 cặp e chung của phân tử N2.
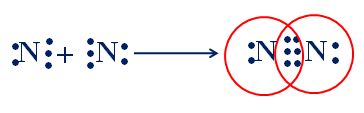
3 cặp electron liên kết biểu diễn bằng ba gạch đó là liên kết ba. Liên kết ba bền hơn liên kết đôi và đơn. Ở nhiệt độ thường N2 kém hoạt động hóa học
CTCT: N≡N
Kết luận
Liên kết cộng hóa trị là liên kết được tạo nên giữa hai nguyên tử bằng một hay nhiều cặp electron chung.
Mỗi cặp electron chung tạo nên một liên kết cộng hóa trị.
Trong các phân tử H2, N2 tạo nên từ hai nguyên tử của cùng một nguyên tố nên cặp electron chung không bị hút về phía nào. Đó là liên kết cộng hóa trị không cực.
b. Liên kết giữa các nguyên tử khác nhau. Sự hình thành hợp chất.
Sự hình thành phân tử hyđro clorua (HCl)
Cấu hình electron của H và Cl là:
1H: 1s1
17Cl: 1s22s22p63s23p5
Nhận xét: Nguyên tử H có 1e ở lớp ngoài cùng, còn thiếu 1e để đạt cấu hình electron bền của khí hiếm He. Nguyên tử Cl có 7e ở lớp ngoài cùng, còn thiếu 1e để có vỏ bền kiểu Ar.
Mỗi nguyên tử H và Cl góp chung 1e để tạo thành 1 liên kết cộng hóa trị.

CTCT: H – Cl
Giá trị độ âm điện của Cl lớn hơn độ âm điện của H nên cặp e liên kết bị lệch về phía nguyên tử Cl. Liên kết cộng hóa trị này bị phân cực.
Cặp electron chung bị lệch về phía một nguyên tử được gọi là liên kết cộng hóa trị có cực hay liên kết cộng hóa trị phân cực.
Sự hình thành phân tử khí cacbon đioxit (CO2)
Cấu hình electron của H và Cl là:
6C : 1s22s22p2
8O: 1s22s22p4
Trong phân tử CO2, nguyên tử C nằm giữa 2 nguyên tử O và nguyên tử C góp chung với mỗi nguyên tử O hai electron.
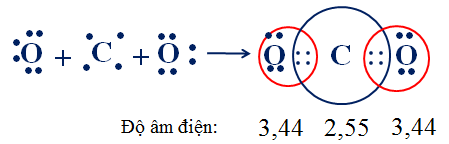
Trong phân tử CO2 các cặp electron bị hút lệch về phía O vì oxi có độ âm điện lớn hơn C → Liên kết C=O bị phân cực về phía O
Trong phân tử CO2 có cấu tạo thẳng nên liên kết đôi phân cực (C=O) triệt tiêu nhau → Phân tử CO2 không phân cực
c. Tính chất của các chất có liên kết cộng hóa trị
Tên các chất mà phân tử chỉ có liên kết cộng hóa trị:
Các chất rắn: đường, lưu huỳnh, iot,..
Các chất lỏng: nước, rượu, xăng, dầu,…
Các chất khí: CO2, Cl2, H2,…
Tính chất của các chất có liên kết cộng hóa trị:
Các chất có cực như: etanol, đường,… tan nhiều trong dung môi có cực như nước.
Phần lớn các chất không cực như: S, I2, các chất hữu cơ không cực tan trong dung môi không cực.
Kết luận: Các chất có liên kết cộng hóa trị không cực không dẫn điện ở mọi trạng thái.
1.2. Độ âm điện và liên kết hóa học
a. Quan hệ giữa liên kết cộng hóa trị không cực, liên kết cộng hóa trị có cực và liên kết ion
Trong phân tử, nếu cặp electron chung ở giữa 2 nguyên tử liên kết ta có liên kết cộng hóa trị không cực.
Nếu cặp electron chung lệch về một nguyên tử thì đó là liên kết cộng hóa trị có cực.
Nếu cặp electron chung lệch hẳn về một nguyên tử ta sẽ có liên kết ion.
b. Hiệu độ âm điện và liên kết hóa học
\(0 \le \Delta \chi < 0,4\) : Liên kết cộng hóa trị không cực
\(0,4 \le \Delta \chi < 1,7\) : Liên kết cộng hóa trị có cực
\(\Delta \chi \ge 1,7\) : Liên kết ion
Trong NaCl: \(\Delta \chi = {\rm{ }}3,16{\rm{ }}-{\rm{ }}0,93{\rm{ }} = {\rm{ }}2,23{\rm{ }} > {\rm{ }}1,7\)
→ liên kết giữa Na và Cl là liên kết ion.
Trong HCl: \(\Delta \chi = {\rm{ }}3,16{\rm{ }}-{\rm{ }}2,2{\rm{ }} = {\rm{ }}0,96{\rm{ }} \to {\rm{ }}0,4 \le \Delta \chi \le 1,7\)
→ liên kết giữa H và Cl là liên kết cộng hóa trị có cực.
Trong H2: \(\Delta \chi = {\rm{ }}2,2{\rm{ }}-{\rm{ }}2,2{\rm{ }} = {\rm{ }}0{\rm{ }} \to {\rm{ }}0 \le \Delta \chi \le 0,4\)
→ Liên kết cộng hóa trị không cực
2. Bài tập minh họa
2.1. Dạng 1: Giải thích sự hình thành của liên kết cộng hóa trị
Bài 1: Dựa vào hiệu độ âm điện các nguyên tố, hãy cho biết có loại liên kết nàotrong các chất sau đây :
AlCl3, CaCl2, CaS, Al2S3?
Hướng dẫn giải
Hiệu dộ âm điện CaCl2 : 2, 16 → Liên kết ion.
Hiệu độ âm điện AlCl3, CaS, Al2S3lần lượt là : 1,55 ; 1,58 ; 0,97 → Liên kết cộng
hóa trị có cực.
Bài 2: X, A, Z là những nguyên tố có số điện tích hạt nhân là 9, 19, 8.
a) Viết cấu hình electron nguyên tử của các nguyên tố đó.
b) Dự đoán liên kết hóa học có thể có giữa các cặp X và A, A và Z, Z và X.
Hướng dẫn giải
a) 9X : 1s22s22p5 Đây là F có độ âm điện là 3,98.
19A : 1s22s22p63s23p64s1Đây là K có độ âm điện là 0,82.
8Z: 1s22s22p4 Đây là O có độ âm điện là 3,44.
b) Cặp X và A, hiệu số độ âm điện là: 3,98 – 0,82 = 3,16 , có liên kết ion.
Cặp A và Z, hiệu số độ âm điện là: 3,44 – 0,82 = 2,62, có liên kết ion.
Cặp X và Z, hiệu số độ âm điện là: 3,98 – 3,44 = 0,54, có liên kết cộng hóa trị có cực
2.2. Dạng 2: Xác định trạng thái lai hóa
Bài 1: Trong mạng tinh thể kim cương, góc liên kết tạo bởi các nguyên tử cacbon là :
A. 90o.
B. 120o.
C. 104o30'.
D. 109o28'.
Hướng dẫn giải
C (kim cương) có lại hóa sp3
⇒ Đáp án D
2.3. Dạng 3: Viết công thức cấu tạo của các phân tử
R là một nguyên tố phi kim. Tổng đại số số oxi hóa dương cao nhất với 2 lần số oxi hóa âm thấp nhất của R là +2. Tổng số proton và nơtron của R nhỏ hơn 34.
a. Xác định R
b. X là hợp chất khí của R với hiđro, Y là oxit của R có chứa 50% oxi về khối lượng. Xác định công thức phân tử của X và Y.
c. Viết công thức cấu tạo các phân tử RO2; RO3; H2RO4.
Hướng dẫn giải
a. Gọi số oxi hóa dương cao nhất và số oxi hóa âm thấp nhất của R lần lượt là +m và -n.
Số oxi hóa cao nhất của R trong oxit là +m nên ở lớp ngoài cùng nguyên tử R có m electron.
Số oxi hóa trong hợp chất của R với hiđro là -n nên để đạt được cấu hình 8 electron bão hòa của khí hiếm, lớp ngoài cùng nguyên tử R cần nhận thêm n electron.
Ta có: m + n = 8. Mặt khác, theo bài ra: +m + 2(-n) = +2 m - 2n = 2.
Từ đây tìm được: m = 6 và n = 2. Vậy R là phi kim thuộc nhóm VI.
Số khối của R < 34 nên R là O hay S. Do oxi không tạo được số oxi hóa cao nhất là +6 nên R là lưu huỳnh.
b. Trong hợp chất X, S có số oxi hóa thấp nhất nên X có công thức phân tử là H2S.
Gọi công thức oxit Y là SOn.
Do %S = 50% nên n = 2. Công thức phân tử của Y là SO2.
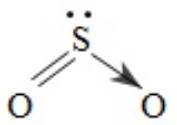
c. Công thức cấu tạo của SO2; SO3; H2SO4:
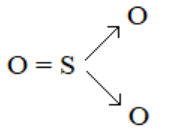
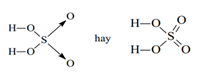
3. Luyện tập
3.1. Bài tập tự luận
Câu 1: X, Y là những nguyên tố có đơn vị điện tích hạt nhân lần lượt là 6, 16. Công thức và liên kết hợp chất tạo thành từ X và Y là
Câu 2: Cho các phân tử N2, HCl, NaCl, MgO. Các phân tử đều có liên kết cộng hóa trị là
Câu 3: Tổng số hạt proton, nowtron, electron của nguyên tử nguyên tố R thuộc nhóm VIIA là 28. Công thức hợp chất của R với hidro là
Câu 4: Hai nguyên tố M và X tạo thành hợp chất có công thức là M2X. Cho biết:
Tổng số proton trong hợp chat M2X bằng 46.
Trong hạt nhân của M có n – p = 1, trong hạt nhân của X có n’ = p’.
Trong hợp chất M2X, nguyên tố X chiếm 8/47 khối lượng phân tử.
Số hạt proton trong hạt nhân nguyên tử M, X và liên kết trong hợp chất M2X lần lượt là?
3.2. Bài tập trắc nghiệm
Câu 1: Liên kết cộng hóa trị được tạo thành bằng
A. sự chuyển hẳn electron từ nguyên tử này sang nguyên tử khác.
B. sự góp chung cặp electron của hai nguyên tử.
C. cặp electron dung chung giữa hai nguyên tử, nhưng cặp electron này chỉ do một nguyên tử cung cấp.
D. sự tương tác giữa các nguyên tử và ion ở nút mạng tinh thể với dòng electron tự do.
Câu 2: Phân tử chất nào sau đây ít phân cực nhất?
A. HCl
B. HF
C. HI
D. HBr
Câu 3: Liên kết trong phân tử chất nào sau đây mang nhiều tính chất cộng hóa trị nhất?
A. KCl
B. AlCl3
C. NaCl
D. MgCl2
Câu 4: Phân tử chất nào sau đây có liên kết cho – nhận?
A. H2O
B. NH3
C. H2O2
D. HNO3
Câu 5: Dãy nào sau đây gồm các chất đều có liên kết π trong phân tử?
A. C2H4, O2, N2, H2S
B. CH4, H2O, C2H4, C3H6
C. C2H4, C2H2, O2, N2
D. C3H8, CO2, SO2, O2
3.3. Trắc nghiệm Online
Các em hãy luyện tập bài trắc nghiệm Liên kết cộng hóa trị Hóa học 10 sau để nắm rõ thêm kiến thức bài học.
4. Kết luận
Sau bài học cần nắm:
- Công thức electron, công thức cấu tạo của một số phân tử cụ thể
- Dự đoán được kiểu liên kết hoá học có thể có trong phân tử gồm hai nguyên tử khi biết hiệu độ âm đỉện của chúng.
Tham khảo thêm
- doc Hoá học 10 Bài 12: Liên kết ion - Tinh thể ion
- doc Hoá học 10 Bài 14: Tinh thể nguyên tử và tinh thể phân tử
- doc Hoá học 10 Bài 15: Hóa trị và số oxi hóa
- doc Hoá học 10 Bài 16: Luyện tập Liên kết hóa học



